
МIНIСТЕРСТВО ОХОРОНИ ЗДОРОВ'Я УКРАЇНИ
НАКАЗ
| вiд 22 сiчня 2020 року | N 142 |
|---|
Про затвердження методичних рекомендацiй iз
застосування Технiчного регламенту щодо
медичних виробiв, затвердженого постановою
Кабiнету Мiнiстрiв України вiд 02 жовтня 2013 року
N 753, Технiчного регламенту щодо медичних
виробiв для дiагностики in vitro, затвердженого
постановою Кабiнету Мiнiстрiв України вiд 02 жовтня
2013 року N 754, та Технiчного регламенту щодо
активних медичних виробiв, якi iмплантують,
затвердженого постановою Кабiнету Мiнiстрiв
України вiд 02 жовтня 2013 року N 755
Вiдповiдно до абзацу третього частини другої статтi 8 Закону України "Про технiчнi регламенти та оцiнку вiдповiдностi", пункту 1 постанови Кабiнету Мiнiстрiв України вiд 16 грудня 2015 року N 1057 "Про визначення сфер дiяльностi, в яких центральнi органи виконавчої влади здiйснюють функцiї технiчного регулювання", абзацу п'ятдесятого пiдпункту 10 пункту 4 та пункту 8 Положення про Мiнiстерство охорони здоров'я України, затвердженого постановою Кабiнету Мiнiстрiв України вiд 25 березня 2015 року N 267, наказую:
Затвердити такi, що додаються:
Методичнi рекомендацiї "Класифiкацiя медичних виробiв";
Методичнi рекомендацiї "Медичнi вироби. Допомiжнi засоби. Виробник.";
Методичнi рекомендацiї "Однорiднi партiї";
Методичнi рекомендацiї "Субпiдряд - зв'язок з системою управлiння якiстю";
Методичнi рекомендацiї "Дата "використати до";
Методичнi рекомендацiї "Сфера застосування Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755";
Методичнi рекомендацiї "Уповноважений представник".
Контроль за виконанням цього наказу залишаю за собою.
| Перший заступник Мiнiстра | А. Семиволос |
| ЗАТВЕРДЖЕНО Наказ Мiнiстерства охорони здоров'я України 22 сiчня 2020 року N 142 |
МЕТОДИЧНI РЕКОМЕНДАЦIЇ
"Класифiкацiя медичних виробiв"
ВСТУП
Методичнi рекомендацiї розроблено на основi Керiвного документа Європейської Комiсiї MEDDEV 2.4/1, редакцiя 9, червень 2010 та не є юридично обов'язковими. Методичнi рекомендацiї розроблено задля однозначного тлумачення норм Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753.
Цей документ мiстить рекомендацiї для застосування правил класифiкацiї медичних виробiв вiдповiдно до додатка 2 до Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753 (далi - ТР щодо МВ).
Можливе вiдступлення вiд правил класифiкацiї в рамках технiчного прогресу або iнформацiї, отриманої пiсля виходу виробу на ринок.
1. Цiлi i принципи класифiкацiї медичних виробiв
Пiддавати усi загалом медичнi вироби найсуворiшим процедурам перевiрки недоцiльно економiчно i невиправдано на практицi. Ступiнчаста система контролю є бiльш доцiльною. У такiй системi рiвень контролю вiдповiдає рiвню потенцiйної небезпеки, властивої типу виробу. Класифiкацiя медичних виробiв необхiдна для визначення застосування вiдповiдної процедури оцiнки вiдповiдностi до медичних виробiв.
З метою гарантування ефективного функцiонування оцiнки вiдповiдностi згiдно з ТР щодо МВ виробники повиннi бути в змозi визначити класифiкацiю свого виробу якомога ранiше, на стадiї проектування.
Класифiкацiя медичних виробiв заснована на вразливостi людського тiла з урахуванням потенцiйних ризикiв, пов'язаних з виробами. Цей пiдхiд дозволяє використовувати набiр критерiїв, якi можна об'єднати в рiзний спосiб для визначення, наприклад, тривалостi контакту з тiлом, ступiнь iнвазивностi i спiввiдношення локального i системного ефекту. Цi критерiї можна застосовувати до широкого кола рiзних медичних виробiв i технологiй. Критерiї класифiкацiї медичних виробiв викладенi в додатку 2 до ТР щодо МВ.
Слiд визнати, що хоча iснуючi правила будуть належним чином класифiкувати переважну бiльшiсть виробiв, все ж може бути важко класифiкувати певну їх кiлькiсть. Такi випадки, зокрема, включають в себе вироби, що межують мiж двома рiзними класами. Крiм того, iснують вироби, якi неможливо класифiкувати згiдно з дiючими правилами через їх незвичайну природу або ситуацiї, коли класифiкацiя призведе до неправильного рiвня оцiнки вiдповiдностi згiдно з небезпекою виробу (див. також роздiл 3.5).
2. Практичне значення класифiкацiї
1) Загальнi вимоги
Незалежно вiд класу виробу вони мають:
- вiдповiдати основним вимогам, включаючи вимоги щодо надання iнформацiї, яка буде поставлятися виробником (додаток 1 до ТР щодо МВ);
- пiдпадати пiд вимоги щодо надання звiтностi вiдповiдно до системи контролю за медичними виробами;
- мати маркування знаком вiдповiдностi (за винятком виробiв, виготовлених на замовлення, i виробiв, призначених для клiнiчних дослiджень).
2) Оцiнка вiдповiдностi
Класифiкацiя медичних виробiв впливатиме на хiд оцiнки вiдповiдностi, яку повинен здiйснити виробник для нанесення маркування знаком вiдповiдностi на медичний вирiб.
Технiчна документацiя щодо виробiв класу IIa i IIb повинна бути розглянута органом з оцiнки вiдповiдностi на основi програми представницької вибiрки в контекстi додаткiв 3, 6 i 7 до ТР щодо МВ.
| Процедури оцiнки вiдповiдностi | Класи | |||||
| Додатки | I | I Стерильнi | I вимiр | IIa | IIb | III |
| 3 (+ перевiрка проекту) | V | |||||
| 3 (- перевiрка проекту) | v | v | v | v | ||
| 4 | v | v | ||||
| 5 | v | v | v | v | v | |
| 6 | v | v | v | v | v | |
| 7 | v | v | v | v | ||
| 8 | v | v | v | v | ||
Клiнiчне оцiнювання та дослiдження
В рамках Основних вимог, клiнiчне оцiнювання вiдповiдно до додатка 10 проводиться щодо всiх медичних виробiв.
У додатку 10 до ТР щодо МВ йдеться, що в якостi загального правила пiдтвердження вiдповiдностi вимогам щодо характеристик i функцiональних властивостей, при звичайних умовах використання виробу, оцiнка небажаних побiчних ефектiв повинна базуватися на клiнiчних даних.
Крiм цього, вiдповiдно до додатка 10 до ТР щодо МВ клiнiчнi дослiдження виробiв, що iмплантують, i виробiв класу III повиннi проводитися, крiм випадкiв, коли належним чином обґрунтоване використання iснуючих клiнiчних даних.
Клiнiчнi дослiдження виробiв класу III, виробiв, що iмплантують i довготермiнових iнвазивних виробiв, що вiдносяться до класу IIa i IIb, можуть бути розпочатi через 60 днiв пiсля повiдомлення виробником компетентного органу, крiм випадкiв, коли компетентний орган повiдомив про протилежне рiшення.
Iнструкцiя iз застосування
Iнструкцiя iз застосування не є обов'язковою для виробiв класу I i IIa, якщо цi вироби можуть безпечно використовуватися без будь-яких iнструкцiй.
Рiзне
Виробник медичних виробiв класу I i його вiдповiдний уповноважений представник, призначений ним, повинен повiдомити свою зареєстровану адресу i опис виробiв компетентному органу.
3) Здiйснення класифiкацiї
Виробник повинен спочатку визначити, чи є продукт медичним виробом або допомiжним засобом до такого медичного виробу.
Основнi визначення
Правила класифiкацiї базуються на рiзних умовах, таких як тривалiсть контакту з пацiєнтом, рiвень iнвазивностi i частина тiла, яка перебуває пiд впливом виробу.
Цiльове призначення
Цiльове призначення визначається виробником.
Тривалiсть
За тривалiстю застосування медичнi вироби подiляються на:
тимчасовi - медичнi вироби, призначенi для безперервного застосування протягом не бiльш нiж 60 хвилин;
короткотермiновi - медичнi вироби, призначенi для безперервного застосування протягом не бiльш нiж 30 днiв;
довготермiновi - медичнi вироби, призначенi для безперервного застосування протягом бiльш нiж 30 днiв.
У певних випадках тривалiсть ефекту виробу слiд розглядати як тривалiсть використання. Наприклад, нанесення крему для шкiри займає всього кiлька секунд, але крем може залишатися на шкiрi протягом багатьох годин. Тому тривалiсть використання не повинна розглядатися як час, необхiдний для застосування виробу, а скорiше як час, протягом якого вирiб досягає проставленої мети.
Поняття неперервного використання
При розрахунку тривалостi безперервне використання встановлюють як час безперервного фактичного використання виробу за призначенням. Однак коли використання виробу припиняється з метою замiни його подiбним або iдентичним виробом, це слiд розглядати як продовження постiйного використання виробу.
Наприклад, скальпель може бути використаний на одному i тому ж пацiєнтi протягом операцiї, яка може тривати кiлька годин. Безперервне використання за призначенням, тобто розрiзання тканин, як правило, триває не бiльше декiлькох секунд. Тому скальпель є виробом тимчасового користування. Однак коли використання виробу припиняється з метою замiни його подiбним або iдентичним виробом (наприклад, замiна уретрального катетера), це слiд розглядати як продовження постiйного використання виробу.
Якщо не можна довести, що компоненти виробу були лiквiдованi в перiод мiж використанням, то це вважається негайною замiною.
Iнвазивнiсть
Слiд вiдзначити наступне:
Хiрургiчно створена стома, що використовується для уростомiї, колостомiї та iлеостомiї або постiйної трахеостомiї, вважається отвором тiла. Тому вироби, що вводяться в такi стоми, не є хiрургiчно iнвазивними. Хiрургiчно створений отвiр для забезпечення доступу до системи кровообiгу, навпаки, не слiд вважати "отвором тiла". Вироби, введенi в такий отвiр, вважаються хiрургiчно iнвазивними.
Вирiб, який поставляє енергiю до тiла, не слiд розглядати як iнвазивний, якщо тiльки енергiя проникає в тiло, а не сам вирiб. Енергiя сама по собi не є виробом, тому не може бути класифiкована. Тiльки вирiб, що генерує енергiю, повинен бути класифiкований. Однак якщо вирiб вводить речовину, незалежно вiд того, чи є ця речовина лiкарським засобом або медичним виробом, така речовина повинна оцiнюватися окремо (наприклад, речовини, що вводяться за допомогою струменевого iнжектора).
Будь-який вирiб, який повнiстю або частково проникає всередину тiла через природнi отвори або через поверхнi тiла, є iнвазивним виробом. Хiрургiчно iнвазивний вирiб завжди передбачає проникнення через штучно створений отвiр, такий як хiрургiчний розрiз, або це може бути отвiр, створений за допомогою голки. Тому хiрургiчнi рукавички i голки, що використовуються зi шприцами, є хiрургiчно iнвазивними.
Поняття хiрургiчно iнвазивний слiд розумiти також як такий, що охоплює рiдини, якi знаходяться в контактi з органами, тканинами або iншими частинами тiла, якщо доступ для таких рiдин здiйснюється через хiрургiчно створенi отвори.
Вироби, що iмплантуються
Одним з ключових елементiв у визначеннi виробу для iмплантацiї є поняття "процедури". Таким чином, такi вироби повиннi залишатися в органiзмi пацiєнта пiсля процедури. Пiд "процедурою" слiд розумiти в цьому контекстi хiрургiчну процедуру, в ходi якої iмплантат помiщається в тiло, i негайний пiсляоперацiйний догляд, пов'язаний з процедурою. Поняття "процедури" не поширюється на завершення терапевтичного лiкування, наприклад, видалення iмплантату має розглядатися як iнша процедура. Таким чином, пластина, яка використовується для зменшення перелому кiстки, являє собою iмплантат, навiть якщо його потiм виймають. У цьому випадку введення пластини i її вилучення - двi рiзнi хiрургiчнi операцiї.
Деякi вироби, що iмплантуються частково, вважаються iмплантатами. Наприклад, якщо здiйснюються операцiї для введення порту для внутрiшньовенних вливань, то такий порт буде залишатися в тiлi протягом як мiнiмум 30 днiв i, отже, буде iмплантатом. Однак безтунельний центральний венозний катетер, який використовується для тимчасового доступу до судин i призначений для вилучення пiсля 7 - 10 днiв, - не є довготермiновим виробом для iмплантацiї. Також i шов для закриття шкiрних ран, який витягується протягом 30 днiв, не вважається iмплантатом.
Активнi медичнi вироби
Дiя щодо перетворення енергiї стосується перетворення енергiї в виробi i/або перетворення на межi мiж виробом i тканинами або в тканинах.
Наприклад, електрод не є активним виробом за цiєю системою класифiкацiї до тих пiр, доки кiлькiсть енергiї на входi i виходi однакова. Наприклад, опiр в проводi, який викликає незначнi змiни мiж входом i виходом, не може вважатися складовою значної змiни. Проте електроди, що використовуються в електрохiрургiї для розрiзу тканини або припiкання, є активними виробами, тому що їх робота залежить вiд енергiї, що виробляється генератором, i їх дiя досягається шляхом перетворення енергiї на межi мiж пристроєм i тканиною або в тканинах. Електроди, призначенi для ЕКГ або ЕЕГ, зазвичай не вважаються активними виробами тому, що вони, як правило, не працюють за рахунок перетворення енергiї.
Застосування правил класифiкацiї
Стосовно подальшої iнтерпретацiї правил класифiкацiї слiд враховувати наступне.
Клас виробу визначає цiльове призначення, а не конкретнi технiчнi характеристики виробу, якщо вони не мають прямого вiдношення до призначення. Наприклад, введення допомiжної речовини, тканин тваринного походження i т. д.
Саме цiльове, а не випадкове, призначення виробу визначає клас виробу. Наприклад, шовний органайзер, призначений для пiдтримки в порядку шовних ниток, що використовуються в операцiї на вiдкритому серцi, не слiд розглядати як iнвазивний вирiб, якщо в звичайному використаннi вiн може перебувати поза пацiєнтом. Подiбним чином, якщо лiкар використовує вирiб в порядку, не передбаченому виробником, це не змiнює клас виробу в рамках оцiнки вiдповiдностi. Проте якщо звичайне клiнiчне застосування виробу змiнюється з плином розвитку клiнiчної практики, яка змiнює цiльове призначення i класифiкацiю виробу, то виробник повинен провести нову оцiнку вiдповiдностi для цiльового призначення.
Цiльове призначення, присвоєне виробником виробу, а не клас, присвоєний подiбним виробам, визначає клас виробу. Наприклад, два шва, що мають однаковий склад, можуть мати рiзне призначення.
В якостi альтернативи класифiкацiї системи в цiлому, визначення класу певного виробу може здiйснюватися по вiдношенню до найпростiшої конфiгурацiї, з урахуванням його власних функцiональних особливостей. Вирiб, який є частиною системи, наприклад, трубка набору для штучного кровообiгу може бути класифiкований як окремий вирiб, а не як частина системи. Однак в такому випадку вирiб повинен мати власне маркування знаком вiдповiдностi.
Подiбнi комбiнованi вироби з частинами, що мають рiзне функцiональне призначення, можна аналiзувати окремо по вiдношенню до кожної з цих частин. Наприклад, дренажний вирiб буде мати iнвазивну трубку i неiнвазивний вирiб для збору. Цi компоненти можуть бути класифiкованi окремо, за умови, що вони також мають окреме маркування знаком вiдповiдностi.
Якщо вирiб можна класифiкувати за кiлькома правилами, то застосовується максимально можливий клас.
Якщо вирiб не призначений для використання виключно або головним чином на певнiй частинi тiла, вiн повинен розглядатися, виходячи з самого критичного спецiального використання. Класифiкацiя повинна бути визначена на основi вимог, що мiстяться в iнформацiї, що надається разом iз виробом. Виробник повинен навести в якостi мiнiмальної вимоги позитивнi i негативнi показання до застосування.
Для того, щоб вирiб мав "цiльове призначення", вказане в певному правилi класифiкацiї, виробник повинен чiтко вказати, що вирiб призначений для такого спецiального використання та iнформацiю, що супроводжує вирiб. В iншому випадку буде вважатися, що вiн має цiльове призначення, яке застосовується i прийняте в широкiй медичнiй практицi.
Як користуватися правилами
Виробник повинен враховувати всi правила для встановлення належної класифiкацiї свого виробу. Цiлком можливо, наприклад, що одне iз загальних правил, якi не є специфiчним для активних виробiв, все одно вiдноситься до цього виробу. Всi характеристики виробiв повиннi прийматися до уваги. Характеристика або комбiнацiя характеристик вiдповiдно до цiльового призначення виробу, що має найвищий клас, визначає клас виробу в цiлому.
При вiдступi вiд правил класифiкацiї, викладених у додатку 2 до ТР щодо МВ, виробники грудних iмплантатiв та замiнникiв тазостегнового, колiнного та плечового суглобiв, а також медичних виробiв, виготовлених з використанням тканин тваринного походження, застосовують бiльш жорстку класифiкацiю.
Практичний приклад
| Простий вирiб для дренажу ран складається з трьох компонентiв, якi слiд взяти до уваги: канюля, трубка i вирiб для збору. Якщо вирiб продається без канюлi, то класифiкацiя канюлi не повинна братися до уваги. Крiм того, передбачається, що зiбранi рiдини не призначенi нi для повторного вливання в органiзм, нi для перероблення для можливого повторного вливання, i що вирiб не призначений для пiдключення до всмоктувальної системи. | Правило / пункт ТР щодо МВ | Клас |
| Хiрургiчна iнвазивна канюля для розмiщення в ранi в плевральнiй порожнинi для дренажу порожнини. | 15 | IIa |
| Неiнвазивна трубка для видалення рiдин органiзму до збирача. | 9 | I |
| Неiнвазивний збирач для надходження рiдин органiзму. | 9 | I |
Однозначним висновком тут є те, що виробник матиме вибiр в застосуваннi класу IIa до всього виробу або проведеннi окремих процедур оцiнки вiдповiдностi для канюлi з одного боку i трубки та збирача - з iншого.
Вирiшення проблем iнтерпретацiї
У разi, якщо виробник не впевнений, як класифiкувати свої вироби, йому слiд спочатку звернутися до органу з оцiнки вiдповiдностi.
У разi, якщо залишилися якiсь сумнiви або непогодження з органом з оцiнки вiдповiдностi, слiд звернутися до вiдповiдного компетентного органу в сферi технiчного регулювання.
4) Роз'яснення спецiальних правил класифiкацiї медичних виробiв
Цей роздiл починається з графiчного перелiку правил, як передмова до пiдроздiлiв спецiальних правил класифiкацiї медичних виробiв. Кожний пiдроздiл починається з загального пояснення правила з подальшим поданням правила у табличному виглядi та прикладiв виробiв, до яких вони застосовуються. Слiд пiдкреслити, що якщо конкретний тип виробу наведено як приклад, це не означає, що такi вироби у всiх випадках вiдносяться до класу, наведеному у прикладi. Цiлком можливо, що деякi виробники визначають до такого виробу зовсiм iнше призначення, нiж те, яке було використане в контекстi виробу.
Графiчний перелiк - схема вказiвок з класифiкацiї медичних виробiв для первинної iдентифiкацiї ймовiрного класу виробу
Примiтка: Завжди перевiряйте точну класифiкацiю, уважно прочитавши всi правила, та використовуйте додаткову допомогу у виглядi цього керiвного документа, як це передбачено в формi загальних пояснень правил та прикладiв виробiв (див. пункт 4 пiдпункт 2).
| ТЕМИ |
| Неiнвазивнi вироби - Правила / пункти 9, 10, 11, 12 ТР
щодо МВ Iнвазивнi вироби - Правила / пункти 13, 14, 15, 16 ТР щодо МВ Активнi вироби - Правила / пункти 17, 18, 19, 20 ТР щодо МВ Спецiальнi правила - Правила / пункти 21, 22, 23, 24, 25, 26 ТР щодо МВ |
Неiнвазивнi вироби
Активнi вироби
Спецiальнi правила
Загальнi роз'яснення правил, практичних питань, приклади
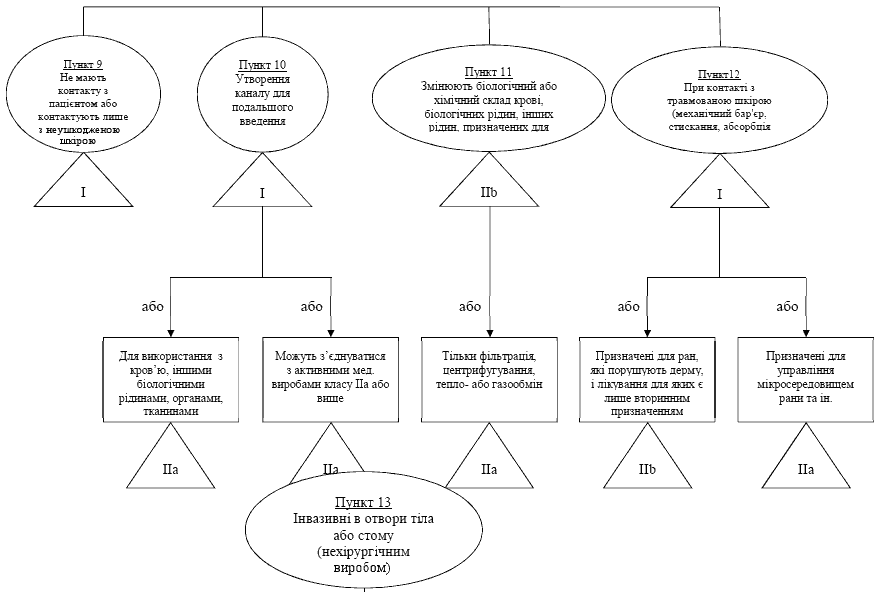
Правило / пункт 9 - Вироби, що не мають контакту з пацiєнтом або контактують лише з неушкодженою шкiрою.
Загальне пояснення правила
Це правило, що застосовується до всiх виробiв, якi не охоплюються бiльш вузьким правилом.
Це правило застосовується в цiлому до виробiв, що вступають в контакт лише з неушкодженою шкiрою або не мають контакту з пацiєнтом.
| Правило / пункт 9 | Приклади |
| Всi неiнвазивнi вироби вiдносяться до Класу I, якщо не можна застосувати одне з викладених нижче правил. | - Вироби для збору рiдин органiзму призначенi
для використання без зворотного потоку рiдин
(наприклад, для збору вiдходiв органiзму, такi як
пляшки для збору сечi, стомнi мiшки, урологiчнi
прокладки або пакети, що використовуються з
виробами для дренажу ран). Вони можуть бути
пiдключенi до пацiєнта катетерами або трубками - Вироби, що використовуються для знерухомлення частин тiла та/або застосування сили до них чи стискання (наприклад, нестерильнi пов'язки для допомоги лiкування розтягнень, гiпс, шийнi комiри, вироби для витягування, компресiйний трикотаж) - Вироби, призначенi в основному для зовнiшньої пiдтримки пацiєнта (наприклад, лiкарнянi лiжка, пiдйомники для пацiєнтiв, милицi, iнвалiднi вiзки, носилки, стоматологiчнi крiсла для пацiєнтiв) - Коригувальнi окуляри та оправи - Стетоскопи для дiагностики - Пластирi для ока - Тканина для закриття ран - Гелi-провiдники - Неiнвазинi електроди (електроди для ЕКГ або ЕЕГ) - Екрани для покращення зображення - Постiйнi магнiти для видалення очного бруду |
Практичнi проблеми класифiкацiї
Деякi неiнвазивнi вироби непрямо контактують з тiлом i можуть впливати на внутрiшнiй фiзiологiчний процес шляхом зберiгання, передачi або лiкування кровi, iнших рiдин органiзму або рiдин, що повернутi або введенi в органiзм, або шляхом генерування енергiї, що надходить до органiзму. Вони повиннi бути виключенi зi сфери застосування цього Правила i застосовуватися вiдповiдно до iншого правила через небезпеку, властиву таким непрямим контактам.
Правило / пункт 10 - Переливання або зберiгання для подальшого введення
Загальне пояснення правила
Цi види виробiв необхiдно розглядати окремо вiд безконтактних виробiв правила / пункту 9, адже вони можуть бути непрямо iнвазивними. Вони направляють або зберiгають речовини, якi в подальшому будуть введенi в органiзм. Як правило, такi вироби використовуються при переливаннi, вливаннi, штучному кровообiгу i введеннi анестезуючих газiв та кисню.
У деяких випадках вироби, що пiдпадають пiд це правило, - це дуже простi вироби для введення.
| Правило / пункт 10 | Приклади |
| Усi неiнвазивнi медичнi вироби, призначенi для
переливання або зберiгання кровi, рiдин i тканин
тiла, а також рiдин або газiв з метою подальшої
iнфузiї, застосування або введення в органiзм,
вiдносяться до класу IIa: якщо вони можуть бути пiд'єднанi до активних медичних виробiв класу IIa або вищого класу; |
- Вироби, призначенi для використання в якостi
каналiв в активних системах введення лiкiв,
наприклад, трубки, що використовуються з
iнфузiйними насосами. - Вироби, що використовуються для направлення, наприклад, антистатичнi трубки для анестезiї, анестезiйних дихальних контурiв, iндикатору тиску, виробiв обмеження тиску. - Шприци для iнфузiйних насосiв. |
| якщо вони призначенi для зберiгання або переливання кровi чи iнших рiдин тiла або для зберiгання органiв, частин органiв або тканин органiзму. | - Вироби, призначенi для направлення кровi
(наприклад, при переливаннi, штучному кровообiгу). - Вироби, призначенi для тимчасового зберiгання або транспортування органiв для трансплантацiї (тобто контейнери, сумки та аналогiчнi вироби). - Вироби, призначенi для довгострокового зберiгання бiологiчних речовин та тканин, таких як роговиця, сперма, ембрiони людини i т. д. (наприклад, контейнери, сумки та аналогiчнi вироби). - Холодильники, спецiально призначенi для зберiгання кровi, тканин тощо. |
| У всiх iнших випадках зазначенi вироби вiдносяться до класу I. | - Вироби, що забезпечують просту функцiю
направлення за допомогою гравiтацiї, що
забезпечує транспортування рiдини, наприклад,
введення набору для iнфузiї. - Вироби, призначенi для тимчасового утримання або зберiгання, наприклад, чашки i ложки, спецiально призначенi для введення лiкiв. - Шприци без голок. |
Практичнi проблеми класифiкацiї
Мiшки з кров'ю як виняток пiдпадають пiд окреме правило (див. Правило / пункт 26).
Якщо вирiб, наприклад, трубки, можна використовувати для цiлей, що призведуть до пiдключення його до активного виробу, такий вирiб автоматично перейде до Класу IIa, якщо виробник не вказує, що його не слiд пiдключати до активного виробу Класу IIa та вище.
Пояснення спецiальних понять
Примiтка: "Може бути пiдключений до активного виробу".
Таке пiдключення iснує мiж неактивним виробом та активним виробом, коли неактивний вирiб утворює зв'язок при передачi речовини мiж пацiєнтом та активним виробом, та один iз виробiв контролює безпеку i роботу iншого. Наприклад, це вiдноситься до трубки в системi штучного кровообiгу, що знаходиться нижче насоса для кровi та контуру кровотоку, але не має прямого контакту з насосом.
Правило / пункт 11 - Неiнвазивнi вироби, що змiнюють бiологiчний або хiмiчний склад кровi, рiдин органiзму або iнших рiдин, призначених для введення в органiзм.
Загальне пояснення правила
Цi типи виробiв слiд розглядати окремо вiд безконтактних виробiв Правила / пункт 9 тому, що вони є непрямо iнвазивними. Це правило поширюється, головним чином, на бiльш складнi елементи наборiв для штучного кровообiгу, систем дiалiзу та систем автотрансфузiї, а також на вироби для штучної обробки рiдин органiзму, що мають бути введенi до органiзму, коли пацiєнт не знаходиться в замкнутiй системi з виробом.
| Правило / пункт 11 | Приклади |
| Усi неiнвазивнi медичнi вироби, призначенi для змiни бiологiчного або хiмiчного складу кровi, iнших рiдин тiла або iнших рiдин, призначених для переливання в тiло, вiдносяться до класу IIб. | - Вироби, призначенi для видалення небажаних
речовин з кровi за допомогою обмiну розчинiв, такi
як вирiб для гемодiалiзу. - Вироби, призначенi для подiлу клiтин за допомогою фiзичних засобiв, наприклад, градiєнтне середовище для подiлу сперми. - Концентрати для гемодiалiзу. |
| У разi, коли лiкування проходить шляхом фiльтрацiї, центрифугування, газо- або теплообмiну, зазначенi вироби вiдносяться до класу IIa. | - Часткова фiльтрацiя кровi в системi штучного
кровообiгу. Використовуються для видалення частинок i емболiй з кровi. - Центрифугування кровi для пiдготовки його до переливання або автотрансфузiї. - Видалення двоокису вуглецю з кровi та/або додавання кисню. - Нагрiвання або охолодження кровi в системi штучного кровообiгу. |
Практичнi проблеми класифiкацiї
Цi вироби зазвичай використовуються в поєднаннi з активним медичним виробом вiдповiдно до Правила / пункт 17 або Правила / пункт 19.
Фiльтрацiю та центрифугування в контекстi цього правила слiд розумiти як виключно механiчнi методи.
Правило / пункт 12 - Неiнвазивнi вироби, що контактують з ушкодженою шкiрою
Загальне пояснення правила
Це правило в першу чергу поширюється на пов'язки для ран незалежно вiд глибини рани. Дiя традицiйних типiв продукцiї, таких як тi, що використовуються в якостi механiчного бар'єру, добре зрозумiла та цi вироби не призводять до великої небезпеки. Можна споглядати швидкий технологiчний розвиток в цiй сферi, з появою нових видiв пов'язок для ран, стосовно яких робляться нетрадицiйнi твердження, наприклад, управлiння мiкросередовищем рани, покращення природного процесу загоєння.
Бiльш амбiтнi твердження стосуються механiзму загоєння, що з'явився як вторинний намiр, такий як вплив на основнi механiзми гранулювання або формування епiтелiю. Деякi вироби, що використовуються на порушенiй дермi, можуть навiть мати за мету пiдтримку або порятунок життя, наприклад, коли присутня повна руйнацiя великої площi шкiри або систематичний ефект.
Вироби, що мiстять лiкарськi засоби, якi дiють як допомiжнi речовини до виробiв, пiдпадають пiд Клас III.
| Правило / пункт 12 | Приклади |
| Усi неiнвазивнi медичнi вироби, що вступають у
контакт з пошкодженою шкiрою: вiдносяться до класу I - якщо призначенi для використання як механiчний бар'єр для компресiї або для абсорбцiї ексудатiв; |
- Рановi пов'язки, такi як: поглинаючi прокладки, вата, рановi смужки, пластирi (лейкопластирi) та марлевi пов'язки, що дiють як бар'єр, пiдтримують рану або поглинають ексудати з рани |
| - вiдносяться до класу IIб - якщо призначенi для використання переважно пiд час лiкування ран, проникають пiд шкiру та лiкування для яких є лише вторинним призначенням; | - Головним чином призначенi для використання на
серйозних ранах зi значним i широким порушенням
дерми, i де процес загоєння може бути тiльки
вторинним намiром, такi як: - пов'язки для хронiчних ран з виразками; - пов'язки для важких опiкiв з обширно порушеною дермою; - пов'язки для серйозних пролежнiв; - пов'язки, що поєднують засоби збiльшення тканини та забезпечення тимчасової замiни шкiри; |
| - вiдносяться до класу IIa - у всiх iнших випадках (зокрема медичнi вироби, призначенi переважно для управлiння мiкросередовищем рани). | - Мають специфiчнi властивостi, призначенi для
сприяння процесу загоєння, контролюючи рiвень
вологостi в ранi пiд час процесу загоєння i в цiлому
для регулювання вологостi та температури
середовища, рiвнiв кисню та iнших газiв i рiвню pH або
шляхом впливу на процес iншими фiзичними
засобами. - Цi вироби можуть мати специфiчнi властивостi загоєння, якi при цьому не призначенi для великих ран, що потребують загоєння. - Лейкопластирi для мiсцевого застосування. - Полiмернi пов'язки. - Гiдрогелевi пов'язки. - Просоченi марлевi пов'язки без лiкарських засобiв. |
Практичнi проблеми класифiкацiї
Продукти, охопленi цим правилом, чутливi до класифiкацiї, наприклад, полiмерна пов'язка буде вiдноситись до Класу IIa, якщо її призначення - управлiння мiкросередовищем рани, або до Класу I, якщо її призначення обмежене збереженням iнвазивної канюлi в ранi. Отже, не можна стверджувати, апрiорi, конкретний клас пов'язки, не знаючи її призначення, визначеного виробником. Бiльшiсть пов'язок класу IIa чи IIb також виконують функцiї Класу I, наприклад, в якостi механiчного бар'єру. Такi вироби класифiкуються вiдповiдно до призначення за вищим класом.
Для виробiв, що поєднують лiкарський засiб або похiднi людської кровi, потрiбно керуватися Правилом / пунктом 21, або для тих, що поєднують тканини тваринного походження або нежиттєздатнi похiднi - керуватися Правилом / пунктом 25.
Пояснення:
- Пошкоджена дерма: рана розкриває принаймнi частково пiдшкiрну тканину.
- Вторинний намiр: рана загоюється спочатку шляхом заповнення грануляцiйною тканиною, а потiм епiтелiй вiдростає поверх грануляцiйної тканини, i рана звужується. На вiдмiну вiд первинного намiру, який передбачає стягування рани, наприклад, шляхом накладання швiв, щоб рана загоїлася.
- Шкiру слiд вважати "ушкодженою" внаслiдок патологiчних змiн (наприклад, дiабетичнi виразки) чи зовнiшнiх факторiв (наприклад, опiки).
Правило / пункт 13 - Вироби, що вводяться в отвори тiла
Загальне пояснення правила
Iнвазивнiсть вiдносно отворiв тiла (вухо, рот, нiс, очi, анус, уретра, пiхва) слiд розглядати окремо вiд проникнення через розрiз на поверхнi тiла (хiрургiчна iнвазивнiсть). Для довготермiнового застосування слiд видiлити iнвазивнiсть вiдносно менш вразливих переднiх частин вуха, рота i носа та iнших анатомiчних дiлянок, що доступнi через природнi отвори тiла.
Хiрургiчно створену стому, що, наприклад, дозволяє видалити сечу або кал, також слiд розглядати як отвори тiла.
Вироби, що пiдпадають пiд це правило, зазвичай є дiагностичними та терапевтичними виробами, якi використовуються вузькими спецiальностями (отоларингологiя, офтальмологiя, стоматологiя, проктологiя, урологiя та гiнекологiя).
| Правило / пункт 13 | Приклади |
| Усi iнвазивнi медичнi вироби, призначенi для введення в отвори тiла, крiм хiрургiчних iнвазивних медичних виробiв, що не призначенi для пiдключення до активних медичних виробiв або що призначенi для пiдключення до активних медичних виробiв класу I: | |
| - вiдносяться до класу I - якщо призначенi для тимчасового застосування; | - Дзеркала, що використовуються в стоматологiї
для стоматологiчної дiагностики та хiрургiї. - Матерiали для зубних злiпкiв. - Трубки для шлунку. - Вiдтиски. - Вироби для клiзми. - Оглядовi рукавички. - Сечовий катетер, призначений для тимчасового застосування. - Дилатацiйний катетер для передмiхурової залози. |
| - вiдносяться до класу IIa - якщо призначенi для короткотермiнового застосування. | - Короткотермiновi коригувальнi контактнi лiнзи. - Трахейнi трубки. - Стенти. - Вагiнальнi песарiї. - Постiйнi сечовi катетери, призначенi для короткотермiнового застосування. |
| У разi застосування у ротовiй порожнинi, носоглотцi, у слуховому проходi до барабанної перетинки або в носовiй порожнинi такi вироби вiдносяться до класу I; | - Перев'язувальнi матерiали для носових
кровотеч - Матерiали для виготовлення зубних протезiв. |
| - вiдносяться до класу IIб - якщо призначенi для довготривалого застосування. | - Уретральнi стенти. - Довготермiновi коригувальнi контактнi лiнзи. - Трахейнi канюлi. - Сечовi катетери, призначенi для довготривалого застосування. |
| У разi, коли такi вироби використовуються у ротовiй порожнинi, носоглотцi, у слуховому проходi до барабанної перетинки або в носовiй порожнинi i не призначенi для поглинання слизовою оболонкою, вони вiдносяться до класу IIa. | - Ортодонтичнi проводи. - Фiксованi зубнi протези. - Герметики для фiссур. |
| Усi iнвазивнi медичнi вироби, призначенi для введення в отвори тiла (крiм хiрургiчних iнвазивних медичних виробiв) з пiдключенням до активних медичних виробiв класу IIa або бiльш високого класу, вiдносяться до класу IIa. | - Трахеостомiчнi або трахейнi трубки, пiдключенi
до апарату штучної вентиляцiї легенiв. - Аналiзатори кровi, помiщенi пiд повiки. - Носовi iригатори. - Носоглотковi дихальнi шляхи. - Волоконна оптика в ендоскопах, з'єднана з хiрургiчними лазерами. - Дренажнi катетери або трубки для дренування шлунка. - Стоматологiчнi аспiраторнi наконечники. |
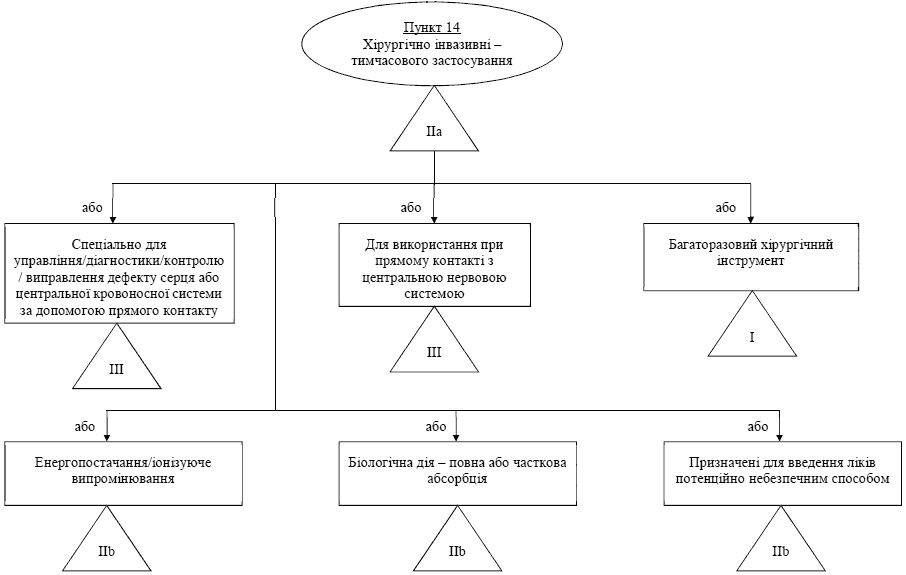
Правило / пункт 14 - Хiрургiчно iнвазивнi вироби, призначенi для тимчасового використання (< 60 хвилин)
Загальне пояснення правила
Це правило, в першу чергу, поширюється на три основнi групи виробiв: вироби для створення провiдника через шкiру (голки, канюлi тощо), хiрургiчнi iнструменти (скальпелi, пили тощо) та рiзнi типи катетерiв, дренажiв тощо.
| Правило / пункт 14 | Приклади |
| Усi хiрургiчнi iнвазивнi медичнi вироби, призначенi для тимчасового застосування, вiдносяться до класу IIa, крiм виробiв, що: | - Голки для накладання швiв. - Голки шприцiв. - Ланцети. - Одноразовi скальпелi i одноразовi леза скальпелiв. - Допомiжнi вироби в офтальмологiчнiй хiрургiї. - Степлери. - Хiрургiчнi тампони. - Свердла, пiдключенi до активних виробiв. - Хiрургiчнi рукавички. - Тестер штучних клапанiв серця. - Тампони для зразкiв ексудатiв. - Одноразовi аортальнi трансплантати (див. примiтку 2). |
| - призначенi спецiально для контролю, дiагностики, монiторингу або корекцiї порокiв2 серця або центральної системи кровообiгу1 шляхом прямого контакту з цими частинами тiла. Такi вироби вiдносяться до класу III3 | - Серцево-судиннi катетери (наприклад, катетери
балонної ангiопластики, катетери/системи для
введення стента), в тому числi пов'язанi дротовi
напрямувачi катетера, iнкубатори та одноразовi4
серцево-судиннi хiрургiчнi iнструменти, наприклад,
електрофiзiологiчнi катетери, електроди для
електрофiзiологiчної дiагностики та абляцiї. - Катетери, що мiстять або з'єднують герметичне джерело радiоiзотопiв, коли радiоактивний iзотоп не призначений для вивiльнення в органiзм при використаннi в центральнiй системi кровообiгу. |
| - багаторазовi хiрургiчнi iнструменти, в цьому випадку вони вiдносяться до Класу I3 | - Скальпелi та ручки скальпелiв. - Розвертки. - Свердла. - Пили, що не призначенi для пiдключення до активного виробу. - Ретракторнi щипцi, екскаватори та зубила. - Ретрактори для грудини для тимчасового використання. |
| - призначенi спецiально для застосування в безпосередньому контактi з центральною нервовою системою. Такi вироби вiдносяться до класу III; | - Нейроендоскопи. - Мозковi шпателi. - Канюлi для прямої стимуляцiї. - Ретрактори спинного мозку. - Спинальнi голки. |
| - призначенi для передачi енергiї у виглядi iонiзуючого випромiнювання. Такi вироби вiдносяться до класу IIб; | - Катетери, що мiстять або з'єднують герметичне джерело радiоiзотопiв, коли радiоактивний iзотоп не призначений для вивiльнення в органiзм при використаннi в системi кровообiгу, за винятком центральної системи. |
| призначенi для бiологiчного впливу5 або для повного чи часткового поглинання6. Такi вироби вiдносяться до класу IIб; | |
| - призначенi для введення лiкувальних засобiв за допомогою системи доставки, якщо це виконується у спосiб, що є потенцiйно небезпечним7 з урахуванням методу застосування. Такi вироби вiдносяться до класу IIб. | - Вироби для повторного самостiйного застосування, коли рiвнi та характер медичного виробу є критичними, наприклад, шприц-ручки з iнсулiном. |
Пояснення спецiальних понять
Примiтка 1: Хiрургiчнi iнструменти, з'єднанi з активним медичним виробом, не слiд вважати "багаторазовим хiрургiчним iнструментом".
Примiтка 2: Вироби для виправлення дефекту не є виробами, що використовуються як допомiжнi в кардiохiрургiчних операцiях, наприклад, затискачi, перфоратор аорти. Перший абзац цього правила не поширюється на перфоратори аорти та аналогiчнi рiжучi iнструменти, що функцiонують подiбно скальпелю.
Примiтка 3: Хiрургiчнi iнструменти, спецiально не призначенi для цiлей, описаних в першому абзацi, i незалежно вiд мiсця застосування, вiдносяться до Класу IIa, якщо вони призначенi для одноразового використання, та до Класу I, якщо вони є багаторазовими.
Примiтка 4: Призначений означає, що цiльове призначення виробу або допомiжного виробу - контролювати, дiагностувати, спостерiгати або коригувати дефект серця або центральної кровоносної системи.
Примiтка 5: Бiологiчна дiя: Всi матерiали i вироби можуть впливати на тканини пiсля застосування в хiрургiчно iнвазивнiй операцiї. Вважається, що матерiал має бiологiчну дiю, якщо вiн активно i навмисно викликає, змiнює чи запобiгає вiдповiдi вiд тканин, оточених специфiчними реакцiями на молекулярному рiвнi. Такий вирiб можна вiднести до бiологiчно активних.
Примiтка 6: Поглинаються повнiстю або частково: термiн абсорбцiї (поглинання) вiдноситься до розпаду матерiалу всерединi органiзму та метаболiчного усунення продуктiв розпаду з органiзму.
Примiтка 7: Поняття "потенцiйно небезпечний спосiб" пов'язане з характеристиками виробу, а не умiннями користувача.
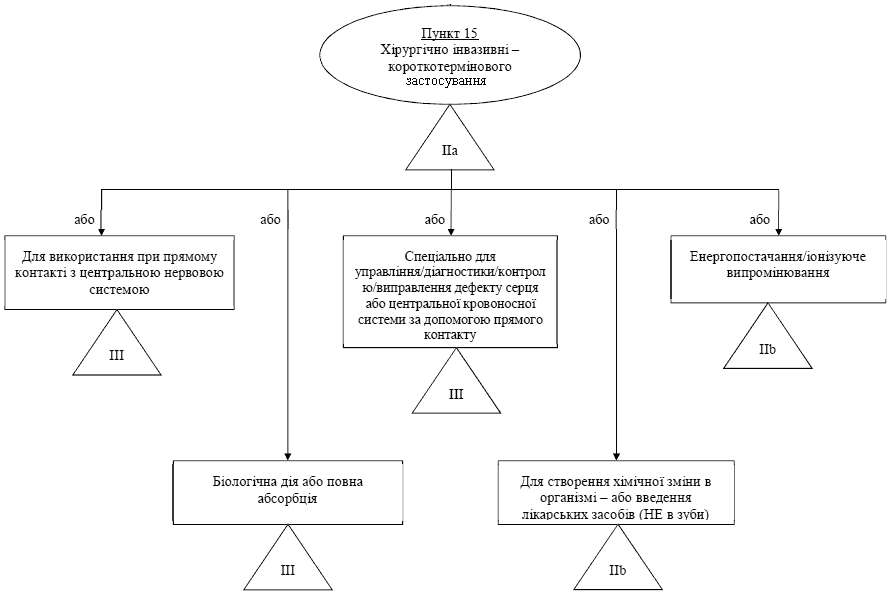
Правило / пункт 15 - Хiрургiчно iнвазивнi вироби для короткотермiнового використання (> 60 хвилин, < 30 днiв)
Загальне пояснення правила
В основному, цi вироби використовуються пiд час операцiї або в перiод пiсляоперацiйного догляду (наприклад, затискачi, дренажi), використання iнфузiйних виробiв (канюлi, голки) та катетерiв рiзних типiв.
| Правило / пункт 15 | Приклади |
| Усi хiрургiчнi iнвазивнi медичнi вироби, призначенi для короткотермiнового застосування, вiдносяться до класу IIa, крiм виробiв, що призначенi: | - Затискачi. - Iнфузiйнi канюлi. - Вироби для закриття шкiри. - Тимчасовi стоматологiчнi матерiали. - Стабiлiзатори2 тканини, що використовуються в кардiохiрургiї. |
| - спецiально для контролю, дiагностики, монiторингу або корекцiї порокiв2 серця або центральної системи кровообiгу шляхом прямого контакту з цими частинами тiла. Такi вироби вiдносяться до класу III; | - Серцево-судиннi катетери. - Серцевi зонди. - Дроти тимчасового кардiостимулятора. - Шунти сонної артерiї. - Аблацiйний катетер. |
| - спецiально для використання в прямому контактi з центральною нервовою системою. Такi вироби вiдносяться до класу III; | - Неврологiчнi катетери. - Кортикальнi електроди. |
| - для передачi енергiї у виглядi iонiзуючого випромiнювання. Такi вироби вiдносяться до класу IIб; | - Вироби для брахiтерапiї. |
| - для здiйснення бiологiчного впливу або для повного або часткового поглинання. Такi вироби вiдносяться до класу III; | - Шви, що розсмоктуються. - Бiологiчнi клеї. |
| - для проведення хiмiчних змiн у тiлi (крiм випадкiв, коли медичнi вироби розташованi в зубах) або для введення лiкарських засобiв1. Такi вироби вiдносяться до класу IIб. | - Клеї. |
Практичнi проблеми класифiкацiї
Примiтка 1: Введення лiкарських засобiв також включає показники зберiгання та/або впливу на обсяг та темп введення лiкiв. Iмплантованi капсули для повiльного введення лiкiв є лiкарськими засобами, а не медичними виробами.
Примiтка 2: Вироби для виправлення дефекту не є виробами, що використовуються як допомiжнi в кардiохiрургiї, наприклад, стабiлiзатори тканини.
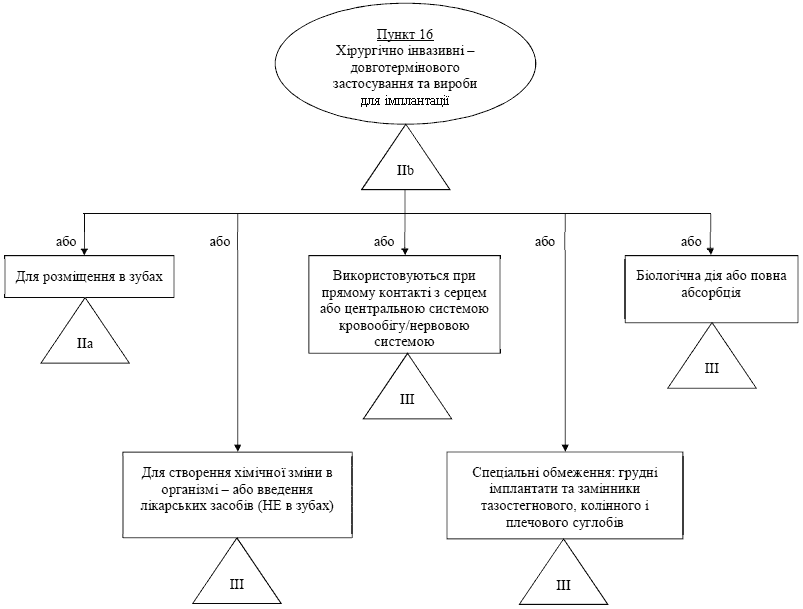
Правило / пункт 16 - Вироби для iмплантацiї та хiрургiчно iнвазивнi вироби довготермiнового використання (> 30 днiв)
Загальне пояснення правила
В основному, це ортопедичнi, стоматологiчнi, офтальмологiчнi, серцево-судиннi iмплантати, а також iмплантати м'яких тканин, що використовуються, наприклад, в пластичнiй хiрургiї.
| Правило / пункт 16 | Приклади |
| Усi медичнi вироби, якi iмплантуються, а також хiрургiчнi iнвазивнi медичнi вироби довготривалого застосування вiдносяться до класу IIб, крiм виробiв, що призначенi для: | - Ортопедичнi замiнники суглобiв, крiм
iмплантованих складових частин систем загальної
замiни суглоба, якi призначенi для забезпечення
функцiї, подiбної до функцiї природного
кульшового суглоба, природного колiнного суглоба
або природного плечового суглоба. - Зв'язки. - Шунти. - Стенти i клапани (наприклад, легеневi). - Внутрiшньоочнi лiнзи. - Iмплантати для нарощення тканини. - Периферичнi судиннi катетери. - Периферiйнi судиннi протези та стенти. - Iмплантати для статевого органу. - Шви, що не розсмоктуються, кiстковий цемент та щелепно-лицевi iмплантати, в'язкопружнi хiрургiчнi вироби, призначенi спецiально для зовнiшнiх офтальмологiчних хiрургiчних операцiй1. |
| - розташування в зубах3. Такi вироби вiдносяться до класу IIa; | - Мости i коронки. - Стоматологiчнi пломбувальнi матерiали та штифти. - Стоматологiчнi сплави, керамiка та полiмери. |
| - використання в безпосередньому контактi з серцем, центральною системою кровообiгу або центральною нервовою системою. Такi вироби вiдносяться до класу III; | - Протези клапанiв серця. - Клiпси для аневризмiв. - Судиннi протези та стенти. - Центрально-судиннi катетери. - Стенти для спинного хребта. - Електроди для ЦНС. - Серцево-судиннi шви. - Постiйнi та тимчасовi фiльтри порожнистої вени. - Вироби для оклюзiї. - Внутрiшньоаортальний балон-насос. - Допомiжнi вироби роботи зовнiшнього лiвого шлуночка. |
| - здiйснення бiологiчного впливу або повного чи часткового поглинання. Такi вироби вiдносяться до класу III; | - Шви, що розсмоктуються |
| - проведення хiмiчних змiн4 у тiлi (крiм випадкiв, коли медичнi вироби розташованi в зубах) або введення лiкарських засобiв1. Такi вироби вiдносяться до класу III. | - Акумуляторнi системи введення неактивних лiкарських засобiв. |
| випадки вiдступiв вiд цих правил, вироби слiд вiдносити до класу III | - Груднi iмплантати |
| випадки вiдступiв вiд правил, вироби слiд вiдносити до класу III | - Системи повної замiни стегнового, колiнного та плечового суглобiв i компоненти системи1. |
Практичнi проблеми класифiкацiї
Примiтка 1: Цi продукти є iмплантатами, тому що за нормальних умов значна кiлькiсть речовини залишається на мiстi операцiї пiсля процедури. Якщо такi вироби мiстять твариннi тканини або їх похiднi, на них поширюється Правило / пункт 25.
Примiтка 2: Для закриття артерiотомiї в периферичнiй судиннiй системi.
Примiтка 3: Iмплантати без бiоактивних поверхонь, призначенi для захисту зубiв або протезiв верхньо- чи нижньощелепної кiстки, вiдносяться до Класу IIb та пiдпорядковуються загальному правилу. Гiдроксиапатит вважається таким, що має бiологiчну дiю, тiльки якщо це стверджується та демонструється виробником.
Примiтка 4: Пункт про хiмiчнi змiни за цим правилом не вiдноситься до таких продуктiв, як кiстковий цемент, коли хiмiчна змiна вiдбувається пiд час розмiщення i не є довготермiновою.
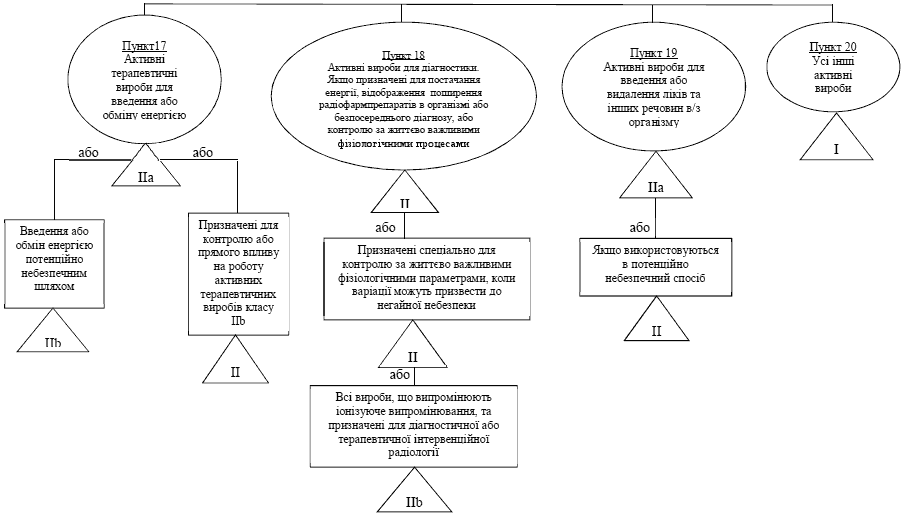
Правило / пункт 17 - Активнi терапевтичнi вироби для введення або обмiну енергiї
Загальне пояснення правила
Вироби, класифiкованi за цим правилом, в основному, електрообладнання, що використовується в хiрургiї, таке як лазери та хiрургiчнi генератори. Крiм того, iснують вироби для спецiалiзованого лiкування, такi як променева терапiя. До iншої категорiї вiдносяться вироби для стимуляцiї, проте не всi вони можуть вважатися такими, що мають небезпечний рiвень енергiї, який надходить до тканини.
| Правило / пункт 17 | Приклади |
| Усi активнi медичнi вироби для терапiї, призначенi для передачi або обмiну енергiєю, вiдносяться до класу IIa, | Електрична та/або магнiтна та електромагнiтна
енергiя: - М'язовi стимулятори. - Зовнiшнi стимулятори росту кiсток - Очнi електромагнiти. - Електрична акупунктура. Термальна енергiя: - Обладнання для крiохiрургiї. - Теплообмiнники, за винятком типiв, описаних нижче. Механiчна енергiя: - Пiдключенi дерматоми. - Пiдключенi свердла. - Стоматологiчнi наконечники. Свiтло: - Фототерапiя для догляду за шкiрою i для догляду за новонародженими. Звук: - Слуховi апарати. Ультразвук: - Обладнання для фiзiотерапiї. |
| крiм виробiв, характеристики яких дають змогу подавати енергiю до людського тiла або здiйснювати енергообмiн в потенцiйно небезпечний спосiб1, з урахуванням властивостей, iнтенсивностi та мiсця застосування енергiї. У такому разi вироби вiдносяться до класу IIб. | Кiнетична енергiя: - Апарати для штучної вентиляцiї легенiв - Iнкубатори для новонароджених - Ковдри для зiгрiвання - Пiдiгрiвачi кровi - Теплообмiнники з електричним приводом (наприклад, такi, що використовуються для пацiєнтiв, що не мають можливостi вiдчувати) Електроенергiя: - Високочастотнi хiрургiчнi генератори i електрокоагуляцiйне обладнання, в тому числi їхнi електроди. - Зовнiшнi кардiостимулятори та дефiбрилятори. - Обладнання для електросудомної терапiї. Когерентне свiтло: - Хiрургiчнi лазери. Ультразвук: - Лiтотрiптери, хiрургiчнi ультразвуковi вироби. Iонiзуюче випромiнювання: - Радiоактивнi джерела для терапiї подальшого введення. - Терапевтичнi циклотрони та лiнiйнi прискорювачi. - Терапевтичнi рентгенiвськi джерела. |
| Усi активнi медичнi вироби, призначенi для контролю або монiторингу характеристик активних медичних виробiв для терапiї класу IIб або призначенi для здiйснення безпосереднього впливу на характеристики таких медичних виробiв, вiдносяться до класу IIб. | - Зовнiшнi системи зворотного зв'язку для
активних терапевтичних виробiв. - Системи контролю для подальшого введення. |
Пояснення спецiальних понять
Примiтка 1: Поняття "потенцiйно небезпечний" залежить вiд типу технологiї та призначення виробу для пацiєнта. Наприклад, всi вироби, призначенi для iонiзуючого випромiнювання, всi апарати для штучної вентиляцiї легенiв та лiтотрiптери слiд вiдносити до Класу IIb.
Правило / пункт 18 - Активнi вироби для дiагностики
Загальне пояснення правила
В першу чергу поширюється на цiлий ряд обладнання широкого використання в рiзних областях, наприклад, ультразвукова дiагностика, забiр фiзiологiчних сигналiв та лiкувально-дiагностична радiологiя.
| Правило / пункт 18 | Приклади |
| Активнi медичнi вироби, призначенi для
дiагностики, вiдносяться до класу IIa: якщо вони призначенi для передачi енергiї, яка буде поглинатися людським тiлом, крiм медичних виробiв, що використовуються для освiтлення тiла споживача у видимiй частинi спектра; |
- Магнiтно-резонансне обладнання. - Апарати для одонтодiагностики. - Стимулятори викликання реакцiї. - Дiагностичний ультразвук. |
| - якщо вони призначенi для отримання зображення розподiлу радiофармацевтичних препаратiв in vivo; | - Гамма камери. - Позитронно-емiсiйна томографiя та емiсiйно-комп'ютерна томографiя. |
| - якщо вони призначенi для прямого
дiагностування або монiторингу життєво важливих
фiзiологiчних процесiв1, крiм тих, що спецiально призначенi для монiторингу життєво важливих фiзiологiчних параметрiв, де властивiсть енергiї є такою, що може створювати безпосередню небезпеку для споживача, зокрема призводити до змiн серцевої дiяльностi, дихання, дiяльностi центральної нервової системи. Такi вироби вiдносяться до класу IIб. |
- Електрокардiографи. - Електроенцефалографи. - Кардiоскопи з чи без показникiв пульсу. - Електроннi термометри. - Електроннi стетоскопи. - Електронне обладнання для вимiрювання тиску. - Вироби для iнтенсивного монiторингу та сигналiзацiї (наприклад, кров'яний тиск, температура, насичення кровi киснем). - Бiологiчнi сенсори. - Аналiзатори газiв кровi, що використовуються в операцiях на вiдкритому серцi. - Кардiоскопи. - Дихальний монiтор, в тому числi дихальний монiтор для домашнього використання. |
| Активнi медичнi вироби, призначенi для
випромiнювання iонiзуючої радiацiї3, а також
для дiагностичної та терапевтичної
iнтервенцiйної радiологiї, включаючи медичнi вироби, призначенi для контролю або монiторингу4 таких медичних виробiв, або такi, що безпосередньо впливають на їх роботу, вiдносяться до класу IIб. |
- Дiагностичнi рентгенiвськi джерела. |
Пояснення спецiальних понять
Примiтка 1: Життєвi фiзiологiчнi процеси i параметри включають, наприклад, дихання, частоту серцевих скорочень, церебральнi функцiї, склад газiв кровi, кров'яного тиску i температуру тiла. Медичнi вироби, призначенi для тривалого спостереження за життєво важливими фiзiологiчними процесами при анестезiї, iнтенсивнiй терапiї або невiдкладнiй медичнiй допомозi, вiдносяться до Класу IIb, в той час як медичнi вироби, призначенi для отримання показань життєвих фiзiологiчних сигналiв при звичайних та самостiйних оглядах, вiдносяться до Класу IIa. Тепловiзiйний вирiб, призначений для монiторингу кровотоку, не вважається пристроєм для вимiрювання температури.
Примiтка 2: Вироби, спецiально призначенi для монiторингу активних медичних виробiв, якi iмплантують, пiдпадають пiд Технiчний регламент щодо активних медичних виробiв, якi iмплантують, затверджений постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755.
Примiтка 3: Терапевтична iнтервенцiйна радiологiя вiдноситься до дiагностики пiд час хiрургiчних операцiй.
Примiтка 4: Це вiдноситься до активних виробiв для контролю, монiторингу або впливу на iонiзуюче випромiнювання, а не до подальшої обробки, запису чи розгляду отриманого зображення.
Правило / пункт 19 - Активнi вироби, призначенi для введення та/або видалення лiкарських засобiв, рiдин органiзму чи iнших речовин в або з органiзму
Загальне пояснення правила
Це правило, в першу чергу, поширюється на системи введення лiкiв та обладнання для анестезiї.
| Правило / пункт 19 | Приклади |
| Усi активнi медичнi вироби, призначенi для введення лiкарських засобiв, рiдин тiла або iнших речовин в тiло та/або видалення їх з тiла, вiдносяться до класу IIa. | - Вакуумне обладнання. - Насос для годування. - Безголковi шприци для вакцинацiї. - Небулайзери для використання на притомних та спонтанно дихаючих пацiєнтах, коли неможливiсть введення вiдповiдної дози не є потенцiйно небезпечною. |
| - У разi, коли зазначене введення або видалення здiйснюється у спосiб, що є потенцiйно небезпечним з урахуванням характеру застосованих речовин, вiдповiдної частини тiла та способу застосування, такi медичнi вироби вiдносяться до класу IIб. | - Iнфузiйнi насоси. - Вентилятори. - Апарати для анестезiї. - Випарники для наркозу. - Обладнання для дiалiзу. - Насос для кровi для апарату "серце-легенi". - Гiпербаричнi камери. - Регулятори тиску для медичних газiв. - Медичнi змiшувачi газiв. - Обмiнники вологи в дихальних контурах при використаннi на непритомних або спонтанно не дихаючих пацiєнтах. - Небулайзери, коли неможливiсть введення вiдповiдної дози може бути небезпечною. |
Правило / пункт 20 - Всi iншi активнi вироби
Загальне пояснення правила
Це правило є додатковим та поширюється на всi активнi вироби, не охопленi попереднiм правилом.
| Правило / пункт 20 | Приклади |
| Решта активних медичних виробiв вiдносяться до класу I. | - Активнi дiагностичнi вироби, призначенi для
освiтлення тiла пацiєнта у видимiй областi спектра,
такi як лiхтарики для огляду, або для оптичного
огляду тiла, такi як хiрургiчнi мiкроскопи. - Вироби, призначенi в основному для зовнiшньої пiдтримки пацiєнта (наприклад, лiкарнянi лiжка, пiдйомники пацiєнта, iнвалiднi крiсла, стоматологiчнi крiсла). - Активнi дiагностичнi вироби, призначенi для термографiї. - Стоматологiчнi свiтловiдбивачi. |
Спецiальнi правила
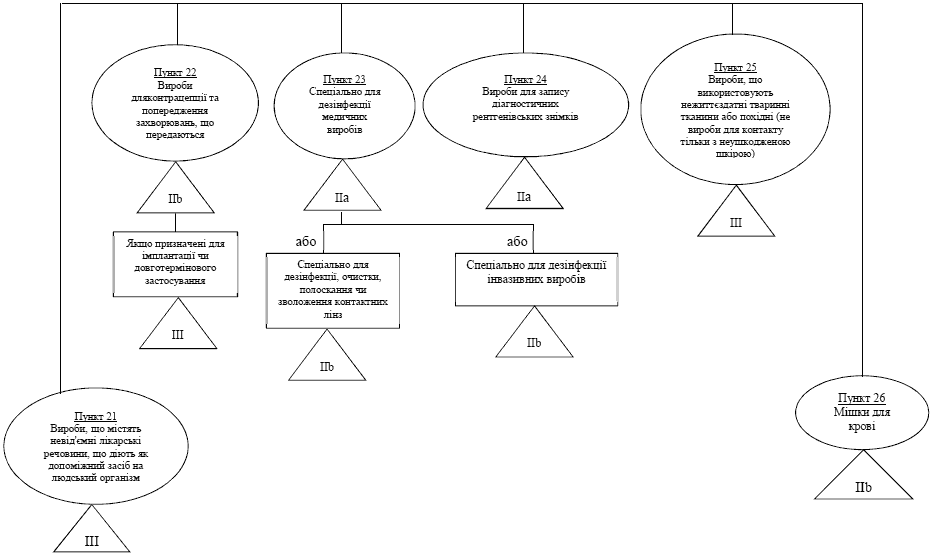
Правило / пункт 21 - Вироби, що мiстять невiд'ємнi лiкарськi речовини або похiднi людської кровi
Загальне пояснення правила
Це правило поширюється на комбiнованi вироби, що мiстять лiкарську речовину для сприяння функцiонуванню цього виробу. Проте це правило не поширюється на тi вироби, що мiстять речовини, що можуть вважатися лiкарськими речовинами, але включенi у вирiб виключно для пiдтримки певних характеристик виробу та не мають впливати на органiзм людини. Основна функцiя виробу не залежить вiд фармакологiчної, метаболiчної або iмунологiчної дiї лiкарського засобу.
| Правило / пункт 21 | Приклади |
| Усi медичнi вироби, якi мiстять як невiд'ємну частину речовину, яка в разi її окремого використання може розглядатися як лiкарський засiб згiдно з визначенням, наведеним у Законi України "Про лiкарськi засоби", i дiя якої на органiзм є допомiжною порiвняно з дiєю медичного виробу, вiдносяться до класу III. | - Кiстковий цемент з антибiотиками. - Презервативи зi спермiцидами. - Катетери з гепариновим покриттям. - Ендодонтичнi матерiали з антибiотиками. - Офтальмологiчнi iригацiйнi розчини, призначенi для iригацiї, що мiстять компоненти для пiдтримки метаболiзму ендотелiальних клiтин рогiвки. - Перев'язувальнi матерiали, що мiстять протимiкробнi засоби, коли мета такого засобу - допомiжна дiя стосовно рани. - Протизаплiднi внутрiшньоматковi спiралi, що мiстять мiдь або срiбло. - Стенти з лiкарськими засобами, наприклад, коронарнi, легеневi. |
| Усi медичнi вироби, якi мiстять як невiд'ємну частину похiднi кровi людини, вiдносяться до класу III. | - Хiрургiчнi герметики, що мiстять сироватковий альбумiн людини. |
Примiтка 1: "Невiд'ємна частина" означає, що вирiб та лiкарська речовина фiзично або хiмiчно поєднанi пiд час введення (використання, iмплантацiї, застосування тощо) пацiєнту.
Правило / пункт 22 - Вироби для контрацепцiї та попередження захворювань, що передаються статевим шляхом
Загальне пояснення правила
Вироби призначенi для використання в окремих випадках людської вразливостi, на яку не поширюються загальнi критерiї часу, iнвазивностi та функцiй органiв.
Хоча це правило поширюється на два дуже рiзнi способи застосування виробiв, деякi вироби можуть виконувати обидвi функцiї, наприклад, презервативи. На вироби, призначенi для запобiгання передачi ВIЛ статевим шляхом, також поширюється це правило.
| Правило / пункт 22 | Приклади |
| Усi медичнi вироби, якi використовуються для контрацепцiї та профiлактики передачi венеричних захворювань, вiдносяться до класу IIб. | - Презервативи. - Контрацептивнi дiафрагми. |
| Медичнi вироби, якi iмплантуються, або iнвазивнi медичнi вироби довготермiнового застосування, якi використовуються iз зазначеною метою, вiдносяться до класу III. | - Протизаплiднi внутрiшньоматковi спiралi1. |
Примiтка 1: Внутрiшньоматковi контрацептиви, основною метою яких є видiлення прогестинiв, не є медичними виробами
Правило / пункт 23 - Спецiально для дезiнфекцiї, очистки та промивання виробiв
Загальне пояснення правила
Це правило, в першу чергу, поширюється на рiзнi розчини для контактних лiнз. Воно також охоплює речовини та iнше обладнання, що використовується в основному в медичному середовищi для дезiнфекцiї медичних виробiв.
| Правило / пункт 23 | Приклади |
| Усi медичнi вироби, спецiально призначенi для дезiнфекцiї, очищення, промивання або в разi потреби - зволоження контактних лiнз, вiдносяться до класу IIб. | - Розчини для контактних лiнз. - Розчини для дезiнфекцiї. |
| Усi медичнi вироби, призначенi спецiально для дезiнфекцiї медичних виробiв, вiдносяться до класу IIа. | - Дезiнфекцiйнi засоби, спецiально призначенi для
неiнвазивних медичних виробiв та обладнання, такi
як стерилiзатори, призначенi для стерилiзацiї
медичних виробiв в медичному середовищi та
мийки-дезiнфектори. - Мийки-дезiнфектори призначенi для дезiнфекцiї неiнвазивних медичних виробiв. |
| Медичнi вироби, що призначенi спецiально для дезiнфекцiї iнвазивних медичних виробiв, вiдносяться до класу IIб. | - Дезiнфекцiйнi засоби для зубних протезiв. - Мийки-дезiнфектори для ендоскопiв. - Дезiнфекцiйнi засоби для трубок обладнання для гемодiалiзу. - Дезiнфекцiйнi засоби для очних протезiв, хiрургiчного обладнання та iнвазивного стоматологiчного обладнання. |
| Зазначенi вимоги не поширюються на медичнi вироби, призначенi для фiзичного очищення медичних виробiв (крiм контактних лiнз)1. |
Практичнi проблеми класифiкацiї
Примiтка 1: Це правило не поширюється на механiчнi засоби очищення виробiв, такi як кистi та ультразвук. Такi вироби пiдпадають пiд ТР щодо МВ тiльки якщо вони спецiально призначенi для використання з медичними виробами.
Правило / пункт 24 - Вироби для запису дiагностичних рентгенiвських знiмкiв
| Правило / пункт 24 | Приклади |
| Медичнi вироби, спецiально призначенi для запису дiагностичних рентгенiвських знiмкiв, вiдносяться до класу IIа. | - Рентгенiвськi знiмки. - Люмiнофорнi пластини. |
Примiтка: Це вiдноситься лише до засобiв запису, таких як рентгенiвськi знiмки, а не до засобiв для подальшого вiдображення.
Правило / пункт 25 - Вироби, що використовують нежиттєздатнi твариннi тканини або похiднi
Загальне пояснення правила
Це правило поширюється на вироби, що мiстять або зробленi з тканин тваринного походження, що були визначенi нежиттєздатними, тобто такими, в яких бiльше немає нiякої можливостi для клiтинної метаболiчної активностi. Вироби, що мiстять живi твариннi тканини та/або будь-якi людськi тканини чи похiднi, виключенi зi сфери застосування ТР щодо МВ.
При виробництвi деяких виробiв може використовуватися промислова сировина, що мiстить малi кiлькостi жиру або жирових похiдних (наприклад, стеарат в полiмерах). Такi речовини не вважаються похiдними тваринних тканин в рамках цього правила.
| Правило / пункт 25 | Приклади |
| Усi медичнi вироби, виготовленi з використанням тканин тварин або нежиттєздатних тканин тварин1, вiдносяться до класу III, крiм випадкiв, коли такi медичнi вироби призначенi для контакту з непошкодженою2 шкiрою. | - Бiологiчнi клапани серця. - Свинячi ксенотрансплантатнi перев'язувальнi матерiали. - Iмплантати та перев'язувальнi матерiали, виготовленi з колагену. - Вироби, що використовують гiалуронову кислоту тваринного походження. |
Практичнi проблеми класифiкацiї
- Вироби, виготовленi з нежиттєздатної тваринної тканини, що прямо контактують тiльки з неушкодженою шкiрою (наприклад, шкiрянi компоненти ортопедичних пристосувань), вiдносяться до класу I вiдповiдно до Правила 1.
Примiтка 1: Похiднi - продукти, що обробляються з тваринної тканини i включають такi речовини, як молоко, шовк, бджолиний вiск, волосся, ланолiн.
Примiтка 2: Неушкоджена шкiра включає шкiру навколо встановленої стоми, якщо шкiра непошкоджена.
Правило / пункт 26 - Мiшки для кровi
Загальне пояснення правила
Це спецiальне правило, що поширюється тiльки на мiшки для кровi.
| Правило / пункт 26 | Приклади |
| Мiшки для кровi вiдносяться до класу IIб. | - Мiшки для кровi (в тому числi такi, що мiстять або
вкритi антикоагулянтом). У випадках, коли мiшки для кровi виконують не тiльки функцiю зберiгання та включають вiдмiннi вiд антикоагулянтiв системи зберiгання (наприклад, правило пункту 21), можуть застосовуватися iншi правила. |
| Генеральний директор Фармацевтичного директорату |
Олександр КОМАРIДА |
| ЗАТВЕРДЖЕНО Наказ Мiнiстерства охорони здоров'я України 22 сiчня 2020 року N 142 |
МЕТОДИЧНI РЕКОМЕНДАЦIЇ
"Медичнi вироби. Допомiжнi засоби. Виробник."
ВСТУП
Методичнi рекомендацiї розроблено на основi Керiвного документа Європейської Комiсiї MEDDEV 2.1/1, квiтень 1994 та не є юридично обов'язковими. Методичнi рекомендацiї розроблено задля однозначного тлумачення норм Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753, Технiчного регламенту щодо медичних виробiв для дiагностики in vitro, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 754 та Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затверджений постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755.
1. Медичнi вироби
1) Медичний вирiб - допомiжний засiб
Медичний вирiб та допомiжний засiб не можна ототожнювати. Для їх розмежування визначальним є визначення термiнiв "медичний вирiб" та "допомiжний засiб", якi наведено у Технiчному регламентi щодо медичних виробiв, затвердженому постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753 (далi - ТР щодо МВ), та у Технiчному регламентi щодо активних медичних виробiв, якi iмплантують, затвердженому постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755 (далi - ТР щодо АМВI). Допомiжнi засоби в цiлях ТР щодо АМВI розглядаються як медичнi вироби, у той час як згiдно з ТР щодо МВ є вiдмiннiсть мiж медичним виробом i допомiжним засобом. Допомiжнi засоби класифiкуються окремо вiд медичних виробiв, з якими вони використовуються;
2) Медичне призначення
Медичне призначення кожного виробу визначається виробником. Вiдповiдно до вимог технiчних регламентiв виробник для кожного свого виробу зазначає медичне призначення на етикетцi, в iнструкцiї iз застосування та рекламних матерiалах. В технiчних регламентах обумовлено захист пацiєнтiв i користувачiв. Тому медичне призначення вiдноситься у загальному розумiннi до готових виробiв, незалежно вiд того, чи призначенi вони для використання окремо, чи разом. Отже, сировина, компоненти або промiжнi продукти, зазвичай, не є медичними виробами. Перераховане повинно мати властивостi або характеристики, якi є визначальними для безпеки готових виробiв. Тому виробник готових виробiв забезпечує вiдповiдний вiдбiр i контроль його сировини або промiжних продуктiв вiдповiдно до пункту 1 роздiлу II додатка 1 ТР щодо МВ.
Комплектувальнi частини, що постачаються для замiни iснуючих компонентiв готового виробу, щодо якого вже була здiйснена оцiнка вiдповiдностi вимогам технiчних регламентiв, не є медичними виробами. У разi, якщо комплектувальнi частини суттєво змiнюють характеристики або показники ефективностi готового виробу, такi комплектувальнi частини рекомендовано вважати окремими медичними виробами;
3) Налаштування
Пiсля доставки кiнцевому користувачевi або споживачевi готовий вирiб може не бути готовим для використання чи застосування. Перед використанням може знадобитись додаткова обробка, пiдготовка, налаштування, установка, монтаж, адаптацiя або пристосування до потреб користувача або пацiєнта. Наприклад, стерилiзацiя медичних виробiв, якi постачаються нестерильними, монтаж систем, виготовлення сумiшi для зубних пломб, адаптацiя протеза до потреб пацiєнта.
Вищезазначенi дiї, як правило, не виконуються виробниками, якщо вони здiйснюються кiнцевим користувачем пiд час використання або пiдготовки до використання. У цьому контекстi необхiдно розрiзняти типову професiйну дiяльнiсть, що здiйснюється медичним працiвником, та дiяльнiсть з обробки та складання, що здiйснюється вiдповiдним фахiвцем.
В останньому випадку такою дiяльнiстю може стати дiяльнiсть з виробництва або складання систем медичних виробiв, процедурних наборiв та процедур стерилiзацiї, як це передбачено пунктами 27 - 30 ТР щодо МВ.
Особливу увагу в даному контекстi слiд придiляти виготовленню виробiв на замовлення. Вироби на замовлення (наприклад, протези, iндивiдуальнi слуховi апарати) в бiльшостi випадкiв є виробами iндивiдуального використання. Перед введенням в обiг медичного виробу, виготовленого на замовлення, виробник повинен провести процедуру, зазначену в додатку 9, i скласти заяву, зазначену в додатку 9 ТР щодо МВ.
У цих випадках промiжнi продукти, спецiально призначенi для виготовлення медичних виробiв на замовлення, рекомендується вважати медичними виробами. Це вiдноситься, в значнiй мiрi, до стоматологiчних сплавiв, модульних компонентiв для протезування, якщо передбачене використання таких виробiв безпосередньо пов'язане з медичними виробами;
4) Медично-гiгiєнiчне призначення
Згiдно визначення "медичний вирiб", яке наведено у ТР щодо МВ, такi вироби, загалом призначенi для використання у медичних цiлях. Тому вироби гiгiєнiчного або косметичного призначення не є медичними виробами навiть у тому випадку, коли вони можуть використовуватись для профiлактики захворювання.
Приклади виробiв, якi, зазвичай, не можуть визначатись як медичнi вироби:
- зубнi щiтки, зубнi палички, зубна нитка;
- дитячi пiдгузки, гiгiєнiчнi тампони;
- контактнi лiнзи без коригувальних функцiй, що призначенi для змiни кольору очей;
- продукти для вiдбiлювання зубiв;
- iнструменти для нанесення татуювань.
Приклади виробiв, якi можуть бути медичними виробами:
- вироби, що вбирають рiдини при нетриманнi;
5) Допомога особам з iнвалiднiстю
У випадку, якщо обладнання призначене для полегшення або компенсацiї iнвалiдностi, необхiдно встановлювати прямий зв'язок мiж коригувальною функцiєю та вiдповiдною особою. Тому якщо цього не досягнуто, обладнання не вважається медичним виробом, наприклад, акустичнi сигнали на свiтлофорах, туалетне обладнання для iнвалiдiв.
6) Програмне забезпечення
Вiдмiннiсть: програмне забезпечення, що впливає на належне функцiонування виробу, i програмне забезпечення, що використовується разом з немедичним обладнанням.
Програмне забезпечення, пов'язане з функцiонуванням медичного виробу, може бути частиною виробу або окремим медичним виробом, якщо воно реалiзується на ринку збуту окремо вiд вiдповiдного медичного виробу.
У випадку, якщо програмне забезпечення призначене для використання з багатофункцiональним iнформацiйним обладнанням, необхiдно встановити вiдмiннiсть мiж програмним забезпеченням, що забезпечує належнi дiагностичнi або терапевтичнi властивостi пристрою, та програмним забезпеченням для обробки загальних даних пацiєнтiв.
Тiльки в першому випадку можна визначити медичне призначення.
Приклади медичних виробiв: програмне забезпечення для обчислення анатомiчних частин тiла, програмне забезпечення для покращення зображення, що призначене для дiагностичних цiлей, програмне забезпечення для програмування медичного виробу.
Медичне призначення виробу вiдсутнє у випадку, коли програмне забезпечення використовується для обробки загальних даних пацiєнта;
7) Багатоцiльовi вироби
Вироби багатоцiльового призначення, якi iнодi можуть використовуватись в медичному середовищi, зазвичай, не є медичними виробами, за винятком виробiв, для яких буде встановлено спецiальне медичне призначення, наприклад, багатоцiльовий ПК, принтер, сканер, магнiтоскоп, монiтор.
2. Допомiжнi засоби
Питання, чи є продукт "медичним виробом" або "допомiжним засобом", не має практичної значущостi. Згiдно iз ТР щодо МВ допомiжнi засоби слiд розглядати як медичнi вироби.
Визначення "допомiжний засiб", яке наведено у ТР щодо МВ, вимагає, щоб допомiжний засiб був спецiально призначений виробником для використання разом з медичним виробом. Передбачене використання допомiжного засобу повинно бути таким, щоб забезпечувати застосування медичного виробу вiдповiдно до його передбаченого використання. Тому продукт може стати допомiжним засобом до медичного виробу тiльки тодi, коли виробник такого продукту встановив його передбачуване використання разом з одним або декiлькома медичними виробами.
Приклади допомiжних засобiв в залежностi вiд визначених обставин використання медичного виробу:
- стерилiзатори для використання в медичному середовищi;
- мiшки для упаковки повторно стерилiзованих медичних виробiв;
- спецiальнi заряднi пристрої для електромедичних виробiв з живленням вiд акумуляторної батареї;
- засоби по догляду за контактними лiнзами, дезiнфiкуючi засоби, якi спецiально призначенi для медичних виробiв;
- спецiальний пристрiй для очистки води, призначений для використання разом з апаратами для дiалiзу;
- газовi балони/пристрої зменшення тиску для використання разом з апаратами для анестезiї.
3. Виробник
Законодавство визначає виробника як фiзичну або юридичну особу, яка вiдповiдає за визначену виробничу дiяльнiсть, пов'язану з медичним виробом з метою його реалiзацiї на ринку пiд власною назвою.
Причиною цього зв'язку з реалiзацiєю на ринку є те, що технiчнi регламенти спрямованi на дотримання вимог щодо захисту виробу пiд час переходу з областi вiдповiдальностi виробника в область вiдповiдальностi користувачiв. ТР щодо МВ не розповсюджується на вироби у випадку, коли медичний вирiб виготовлений користувачем (наприклад, лiкарнею) без передачi iншiй особi. Проте це стосується виключно такої власної виробничої дiяльностi, коли медичний вирiб залишається разом з користувачами в установi, i не стосується тих випадкiв, коли, наприклад, лiкарня виготовляє ортопедичнi вироби для використання пацiєнтами.
| Генеральний директор Фармацевтичного директорату | Олександр КОМАРIДА |
| ЗАТВЕРДЖЕНО Наказ Мiнiстерства охорони здоров'я України 22 сiчня 2020 року N 142 |
МЕТОДИЧНI РЕКОМЕНДАЦIЇ
"Однорiднi партiї"
ВСТУП
Методичнi рекомендацiї розроблено на основi Керiвного документа Європейської Комiсiї MEDDEV 2.5/6 версiя 1, лютий 1998 та не є юридично обов'язковими. Методичнi рекомендацiї розроблено задля однозначного тлумачення норм Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753, Технiчного регламенту щодо медичних виробiв для дiагностики in vitro, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 754, та Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755.
Однорiднiсть виробничих партiй
Деякi статистичнi процедури оцiнки вiдповiдностi мають значення тiльки для партiй (lots), якi є однорiдними.
Партiя вважається однорiдною, якщо еквiвалентнi частини або матерiали виготовленi та/або протестованi у єдиний спосiб, без перерви, як правило, в той же день або в той же перiод часу, i виготовляються тiєю ж особою або з такими ж налаштуваннями обладнання i вiдповiдають тiй же специфiкацiї.
Для медичних виробiв для дiагностики in vitro i деяких iнших медичних виробiв, таких як стоматологiчнi матерiали, додатково застосовується наступне визначення: Сумiшi речовин, такi як реагенти алiквоти з тiєї ж об'ємної сумiшi, вважаються однорiдними, якщо процес змiшування та алiквоти пiдтверджено1.
____________
1 В ДСТУ ISO 2859 "партiя"
визначається так само, як i "однорiдна партiя"
даного роздiлу.
| Генеральний директор Фармацевтичного директорату | Олександр КОМАРIДА |
| ЗАТВЕРДЖЕНО Наказ Мiнiстерства охорони здоров'я України 22 сiчня 2020 року N 142 |
МЕТОДИЧНI РЕКОМЕНДАЦIЇ
"Субпiдряд - зв'язок з системою управлiння
якiстю"
ВСТУП
Методичнi рекомендацiї розроблено на основi Керiвного документа Європейської Комiсiї MEDDEV 2.5/3, редакцiя 2, червень 1998 та не є юридично обов'язковими. Методичнi рекомендацiї розроблено задля однозначного тлумачення норм Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753, Технiчного регламенту щодо медичних виробiв для дiагностики in vitro, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 754, та Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755.
Розглянемо для прикладу Технiчний регламент щодо медичних виробiв, затверджений постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753 (далi - ТР щодо МВ).
Вiдповiдно до пункту 6 додатка 3, пункту 6 додатка 6, пункту 4 додатка 7 до ТР щодо МВ процедура оцiнювання в разi потреби має включати iнспектування постачальникiв виробника з метою перевiрки виробничих процесiв.
Органу з оцiнки вiдповiдностi слiд звернути увагу на два основних питання при розглядi субпiдрядникiв:
1) чи субпiдрядник бере iстотну участь у розробцi та/або виробництвi виробу?
2) чи субпiдрядник постачає деталi, матерiали або послуги, якi можуть вплинути на вiдповiднiсть виробу основним вимогам технiчних регламентiв?
Якщо вiдповiдь на обидва питання 1) i 2) "НI", нiяких подальших дiй не потрiбно здiйснювати.
Якщо вiдповiдь на вищенаведенi питання 1) або 2) "ТАК", то орган з оцiнки вiдповiдностi повинен оцiнити, чи достатньо доказiв компетентностi субпiдрядника для постачання деталей, матерiалiв або послуг, пов'язаних з медичним виробом(-ами), що розглядаються. Оцiнка буде стосуватися рiзних аспектiв, включаючи контроль, що здiйснюється виробником за дiяльнiстю субпiдрядника.
Орган з оцiнки вiдповiдностi може не проводити аудит субпiдрядника, але лише у тому випадку, якщо буде доведено, що iнший орган з оцiнки вiдповiдностi, компетентний стосовно оцiнки частин, матерiалiв або послуг, провiв оцiнку субпiдрядника щодо частин, матерiалiв чи послуг i засвiдчив компетентнiсть субпiдрядника в цiй областi.
У всiх iнших випадках органу з оцiнки вiдповiдностi повинна бути надана можливiсть розглянути актуальнiсть або критичнiсть субпiдрядника для медичного виробу, i, якщо наданi виробником докази є незадовiльними, орган з оцiнки вiдповiдностi має здiйснити аудит/оцiнку субпiдрядника або вимагати виробника провести повторну оцiнку субпiдрядника1.
____________
1 Для цiлей цiєї
рекомендацiї термiн "субпiдрядник"
використовується для позначення термiнiв
директиви "субпiдрядник" i
"постачальник".
| Генеральний директор Фармацевтичного директорату | Олександр КОМАРIДА |
| ЗАТВЕРДЖЕНО Наказ Мiнiстерства охорони здоров'я України 22 сiчня 2020 року N 142 |
МЕТОДИЧНI РЕКОМЕНДАЦIЇ
"Дата "використати до"
ВСТУП
Методичнi рекомендацiї розроблено на основi Керiвного документа Європейської Комiсiї MEDDEV 2.2/3 верс. 3, червень 1998 та не є юридично обов'язковими. Методичнi рекомендацiї розроблено задля однозначного тлумачення норм Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753, Технiчного регламенту щодо медичних виробiв для дiагностики in vitro, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 754, та Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755.
1. Мета цих рекомендацiй
Мета цих рекомендацiй полягає в тому, щоб:
1) сприяти у прийняттi рiшення виробником про те, що дата "використати до" необхiдна для його конкретного виробу;
2) вказують на те, яка iнформацiя необхiдна для пiдтвердження його рiшення.
2. Вимоги
Технiчний регламент щодо медичних виробiв, затверджений постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753 (далi - ТР щодо МВ), Технiчний регламент щодо медичних виробiв для дiагностики in vitro, затверджений постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 754 (далi - ТР щодо МВ in vitro), Технiчний регламент щодо активних медичних виробiв, якi iмплантують, затверджений постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755 (далi - ТР щодо АМВI) вимагають вказувати на медичному виробi та/або на його упаковцi, та/або у супровiднiй iнформацiї, що супроводжує вирiб, будь-якi часовi обмеження щодо безпечного використання виробу. Хоча формулювання вiдрiзняються, технiчнi регламенти встановлюють необхiднiсть надання цiєї iнформацiї:
| ТР щодо МВ, додаток 1 | ТР щодо МВ in vitro, додаток 1 | ТР щодо АМВI, додаток 1 |
| 44. Етикетка медичного виробу повинна мiстити
такi елементи: 5) в разi потреби - строк, до якого гарантовано безпечне застосування медичного виробу, iз зазначенням року та мiсяця; |
40. Етикетка виробу повинна мiстити таку
iнформацiю... ... дату, до настання якої сам вирiб чи його частина можуть безпечно використовуватися без погiршення експлуатацiйних характеристик, у такому порядку: рiк, мiсяць та в разi потреби - день; |
15. Кожен вирiб повинен мiстити такi вiдомостi... зазначення строку придатностi для безпечної iмплантацiї виробу; |
Щодо виробiв, на якi поширюється дiя ТР щодо АМВI, дата придатностi завжди повинна бути вказана.
У випадку виробiв, охоплених ТР щодо МВ та ТР щодо МВ in vitro, обмеження за часом необхiдне "в разi потреби" (або "необхiдне")1.
____________
1 Обмеження часу
"використати до" вiдноситься до перiоду до
першого використання i не має стосунку до числа
або перiоду подальшого використання ("часу
життя" виробу).
Якщо вирiб багаторазовий, ТР щодо МВ окремо вимагає наводити iнформацiю щодо будь-яких обмежень кiлькостi повторних застосувань.
Якщо вирiб призначений для одноразового використання, але зберiгається протягом тривалого перiоду, будь-якi обмеження на цей перiод та особливостi використання потрiбно зазначати як пiдпункти 10, 11 пункту 44 додатка 1 ТР щодо МВ:
iнформацiю про будь-якi спецiальнi iнструкцiї з експлуатацiї;
iнформацiю про будь-якi запобiжнi заходи та/або застереження2.
____________
2 ТР щодо МВ не
забороняє виробнику добровiльно встановлювати
дату "використати до", навiть якщо дiя i
характеристики насправдi не змiнюються з плином
часу.
3. Як вирiшити, що дата "використати до" необхiдна?
Наносити дату "використати до" потрiбно, коли пов'язанi з безпекою характеристики або заявлена дiя можуть погiршитися з плином часу.
При прийняттi рiшення, чи є таке погiршення "пов'язане з безпекою", виробник повинен звернутися до результатiв аналiзу ризикiв та заходiв, прийнятих для управлiння ризиками.
1) аналiз ризикiв визначатиме дiю i характеристики, що необхiднi для безпечного використання конкретного виробу.
Наприклад, аналiз ризику може показати, що стерильнiсть необхiдна для безпечного використання. Водночас аналiз ризику не буде охоплювати колiр виробу, якщо це лише аспекти естетики, але може враховувати його, якщо цей колiр нанесено з метою, пов'язаною з безпечним використанням виробу (наприклад, колiр визначає розмiр самого виробу);
2) аналiз ризикiв i заходи з управлiння ризиками будуть також визначати рiвень або ступiнь ефективностi або характеристики, але тiльки в тiй мiрi, в якiй вони впливають на безпечне використання виробу.
Наприклад, рiвень опору потоку газу або швидкостi витоку з дихальної системи, або ймовiрнiсть, що вирiб стане нестерильним;
3) аналiз ризику i заходи з управлiння ризиками будуть також визначити перiод, протягом якого ефективнiсть або характеристики залишаються сталими, щоб забезпечити безпечне використання, у тому числi щодо термiну придатностi i передбачуваного перiоду використання.
Наприклад, перiод, протягом якого батарея кардiостимулятора зберiгає достатньо енергiї для функцiонування пiсля iмплантацiї, такий же, як визначений виробником.
4. Iнформацiя, яка потрiбна для пiдтримки рiшення
1) Iнформацiя, яка необхiдна, якщо встановлено дату "використати до"
Виробник повинен продемонструвати, що вiдповiднi дiя i характеристики виробу зберiгаються протягом заявленого термiну придатностi, який вiдображається датою "використати до".
Це може бути досягнуто шляхом та/або:
перспективних дослiджень з використанням прискореного старiння, валiдованих з кореляцiєю деградацiї реального часу;
ретроспективних дослiджень, що використовують реальний досвiд часу, наприклад, з використанням тестування збережених зразкiв, огляду iсторiї скарг чи опублiкованої лiтератури i т. д.
2) Iнформацiя, яка необхiдна, якщо не визначено дату "використати до"
Так як вiдсутнiсть дати "використати до" являє собою неявне декларування нескiнченного термiну придатностi, виробник повинен продемонструвати та/або:
вiдсутнiсть пов'язаної з безпекою дiї або характеристик, якi б, ймовiрно, погiршилися за тривалий час (пiдпункт 1 пункту 3);
у разi будь-якого ймовiрного погiршення (пiдпункт 2 пункту 3) не являють собою неприйнятний ризик;
що перiод, протягом якого вiдбувається погiршення, перевищує межу ймовiрного часу першого використання виробу (пiдпункт 3 пункту 3), наприклад, 30 рокiв.
При цьому виробник повинен розглянути, серед iншого:
матерiали самого виробу, що використовуються у виробництвi, у тому числi клеї, покриття, упаковки i т. д.;
методи виготовлення (наприклад, крiплення компонентiв, процес герметизацiї упаковки);
методи захисту виробу або їх частини вiд псування (наприклад, упаковку, iнструкцiї для зберiгання);
при необхiдностi, стан, в якому вирiб має знаходитися до першого використання (наприклад, без встановленої батареї);
потенцiальну деградацiю з часом певних матерiалiв (наприклад, деградацiя полiмеру за рахунок довгострокових ефектiв стерилiзацiї вiльними радикалами з гамма-опромiненням).
Якщо виробник не може виконати вищезазначенi вимоги абзацу третього пiдпункту 2 або абзацу шостого пiдпункту 2, або абзацу восьмого пiдпункту 2, то дата "використати до" повинна бути вказана.
5. Приклади:
1) Серцевий катетер з балоном iз латексу3
____________
3 В даному прикладi
розглядається тiльки аспект: погiршення стану
балону з часом.
Серцевий катетер включає в себе балон з латексу, що розташований на його кiнцi i тимчасово закриває кровоносну судину. Здатнiсть балона витримувати певний тиск необхiдна для безпечного використання. Якiсть латексу балона, однак, з часом погiршується. Упаковка та правила зберiгання захищають вирiб вiд свiтла, зменшують швидкiсть руйнування, але не запобiгають йому. Тому необхiдно вказувати дату "використати до".
Виробник повинен продемонструвати, що балон з латексу залишається в змозi витримати заявлений тиск впродовж вiдповiдного термiну придатностi, якщо вирiб зберiгається у вiдповiдностi до вказiвок виробника.
2) Ортопедичний iмплантат тазостегнового суглоба (постачається стерильним)4
____________
4 В даному прикладi
розглядається тiльки аспект: погiршенням
стерильної упаковки з часом.
Метало-керамiчний ортопедичний iмплантат постачається стерильним в композитному контейнерi з пластику/паперу. Здатнiсть упаковки пiдтримувати стерильнiсть є необхiдною для безпечного використання. У той час, як пiдтримка стерильностi залежить вiд обставин (тобто в залежностi вiд фактичних умов зберiгання та поводження), стерильнiсть також залежить i вiд часу, в результатi, наприклад, зниження гнучкостi та мiцностi, щiльностi пакувального матерiалу, що робить його бiльш сприйнятливим до подiй, якi можуть вплинути на стерильнiсть.
Окрiм того, оскiльки такi iмплантати доступнi в рiзних розмiрах, конкретний вирiб може залишатися в його упаковцi протягом тривалого часу, поки вiн не буде потрiбний для iмплантацiї.
Тому необхiдно вказувати дату "використати до". Щодо пiдтримки стерильностi, дата "використати до" буде вiдображати:
а) пов'язане з часом погiршення характеристик паковання, наприклад iзоляцiю, цiлiснiсть i стiйкiсть до проникнення часток, що несуть мiкроорганiзми;
б) ймовiрнiсть пошкодження пiд час транспортування i зберiгання, що призводять до порушення стерильностi, але не є очевидними, а, отже, попередження про невикористання виробу при пошкодженнi паковання не допоможе.
Виробник повинен продемонструвати, що:
- пакувальний матерiал здатний зберiгати стерильнiсть виробу довше нiж заявлений термiн придатностi за умови зберiгання вiдповiдно до iнструкцiй виробника.
| Генеральний директор Фармацевтичного директорату | Олександр КОМАРIДА |
| ЗАТВЕРДЖЕНО Наказ Мiнiстерства охорони здоров'я України 22 сiчня 2020 року N 142 |
МЕТОДИЧНI РЕКОМЕНДАЦIЇ
"Сфера застосування Технiчного регламенту
щодо активних медичних виробiв, якi iмплантують,
затвердженого постановою Кабiнету Мiнiстрiв
України вiд 02.10.2013 N 755"
ВСТУП
Методичнi рекомендацiї розроблено на основi Керiвного документа Європейської Комiсiї MEDDEV 2.1/2rev2 April 1994 та не є юридично обов'язковими. Методичнi рекомендацiї розроблено задля однозначного тлумачення норм Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753, та Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755.
Данi рекомендацiї необхiдно застосовувати разом з Технiчним регламентом щодо медичних виробiв, затвердженим постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753 (далi - ТР щодо МВ), та Технiчним регламентом щодо активних медичних виробiв, якi iмплантують, затвердженим постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755 (далi - ТР щодо АМВI), що, в свою чергу, забезпечує практичне пiдтвердження однакового застосування вказаних технiчних регламентiв.
1. Активний медичний вирiб, який iмплантують
1) ТР щодо АМВI застосовується пiд час введення в обiг та/або введення в експлуатацiю активних медичних виробiв, якi iмплантують.
Дiя ТР щодо АМВI поширюється на активнi медичнi вироби, якi iмплантують, якщо вони вiдповiдають визначенню, наведеному в цьому Технiчному регламентi. Це означає, що вироби повиннi бути за визначенням "медичними виробами", якi є одночасно "активними", та "виробами, якi iмплантують".
Станом на квiтень 2019 року чинна версiя Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755, не мiстить визначення "медичний вирiб", як це визначено Директивою Ради ЄС вiд 20 червня 1990 р. N 90/385/ЄЕС щодо наближення законодавства держав-членiв в частинi активних медичних виробiв, якi iмплантують. Тому слiд керуватися визначенням "медичний вирiб", визначеного Директивою Ради ЄС вiд 20 червня 1990 р. N 90/385/ЄЕС в частинi визначення "медичного виробу" до внесення вiдповiдних змiн.
2) Пiд визначенням "медичний вирiб" згiдно з ТР щодо АМВI слiд розумiти будь-який iнструмент, апарат, прилад, матерiал або iнший вирiб, незалежно вiд того, використовується вiн окремо або в комбiнацiї разом з будь-якими допомiжними засобами або програмним забезпеченням для його належного функцiонування, призначений виробником з метою використання для людей в цiлях:
- дiагностики, профiлактики, монiторингу, лiкування або полегшення захворювання або травми,
- дослiдження, замiни або змiни анатомiї або фiзiологiчного процесу,
- контролю процесу зачаття,
та основна передбачувана дiя яких в органiзмi або на органiзм людини не досягається за допомогою фармакологiчних, iмунологiчних або метаболiчних засобiв, але функцiонуванню яких такi засоби можуть сприяти.
Пiд визначенням "медичнi вироби" розумiють вироби, призначенi для використання в лiкувальних цiлях, "якi застосовуються окремо або разом з будь-якими допомiжними засобами, або програмним забезпеченням для їх належного функцiонування". Медичне призначення може бути досягнуто шляхом застосування "одиночного виробу" або декiлькох виробiв, що дiють одночасно один з одним, утворюючи систему. Якщо медичне призначення досягається системним шляхом, кожен елемент системи можна розглядати як медичний вирiб. Визначення медичного виробу може застосовуватися стосовно системи, як такої, або до взаємозамiнних частин, призначених для формування системи разом з iншими виробами, тому для цiлей ТР щодо АМВI, кожна частина якої належить до такої системи, охоплюється ТР щодо АМВI незалежно вiд того, чи є така частина сама по собi "активною", "активно iмплантованою", чи нi.
Приклади активних медичних виробiв, якi iмплантують:
- електричний кардiостимулятор, який iмплантують;
- електричний кардiостимулятор, який iмплантують без електрода;
- електрод;
- вирiб введення лiкарських засобiв з/без катетера, який iмплантують;
- катетер виробу для введення лiкарських засобiв, який iмплантують;
3) Згiдно з метою ТР щодо АМВI медичний вирiб є активним, якщо його робота залежить вiд наявностi джерела електричної енергiї або будь-якого iншого джерела енергiї, крiм безпосередньо генерованої людським органiзмом або силою тяжiння (гравiтацiї). Це включає в себе, наприклад, вироби, що активуються за допомогою тиску, за винятком того випадку, коли ефект досягається енергiєю, яка надходить з органiзму пацiєнта. Пiд визначенням розумiється, що функцiя виробу включає використання джерела енергiї для здiйснення корисної роботи. Проста передача тепла, свiтла, тиску або вiбрацiї не означає, що вирiб є активним.
Приклади:
- зниження тиску при гiдроцефалiї дозволяє випустити спинномозкову рiдину, коли пружина ослаблена, вирiб не є "активним". Навiть якщо положення пружини може регулюватись електромагнiтними засобами, вирiб залишається неактивним, оскiльки медична функцiя виробу полягає в зменшеннi тиску, а не в регулюваннi;
- вирiб введення лiкарського засобу, в якому лiкарський засiб рухається вiд резервуара за допомогою збереженого джерела енергiї (пружина, рiдина, газ тощо...), є "активним";
- внутрiшньосудинний катетер, що мiстить волокно-оптичний джгут, пiд'єднаний до зовнiшнього джерела свiтла, може використовуватись для вимiрювання тиску або iнших параметрiв кровi, якщо показники променю свiтла будуть змiнюватись в залежностi вiд параметрiв кровi та будуть реєструватись виробом. Хоча система в цiлому залежить вiд джерела живлення, для досягнення своєї медичної функцiї (вимiрювання параметрiв кровi) iнвазiйний елемент не є "активним", оскiльки вiн тiльки передає свiтло;
- кохлеарний iмплантат, що активується за допомогою зовнiшнього передавача енергiї, вважається "активним", оскiльки iмплантований компонент, безумовно, залежить вiд джерела живлення для його функцiонування i його мета полягає в перетвореннi енергiї, яку вiн отримує, в електричнi сигнали, якi є тригером вiдповiдних каналiв сенсорного сприйняття в головному мозку, тобто вiн виконує корисну роботу.
4) Активний медичний вирiб є "виробом, який iмплантують", якщо вiн призначений для повного або часткового введення в тiло пацiєнта хiрургiчним чи iншим медичним шляхом або через природний отвiр, що повинен залишатися в тiлi пiсля закiнчення процедури введення.
ТР щодо АМВI був розроблений для активних медичних виробiв, якi можуть характеризуватись потенцiйно високим ризиком внаслiдок того, що вони повнiстю або частково iмплантуються в органiзм. Такi вироби можуть становити небезпеку, зокрема, у зв'язку з неможливiстю їх обслуговування, калiбрування чи контролю, та внаслiдок проблем, пов'язаних iз старiнням матерiалiв, як зазначено в декiлькох основних вимогах Додатка 1 до ТР щодо АМВI. Тому властивiсть "вирiб, який iмплантують" повинна iнтерпретуватися з урахуванням того, що цi небезпеки є типовими для iмплантованих медичних виробiв.
З вищезазначених причин, зовнiшнiй насос введення лiкарських засобiв, як для довготривалого, так i для постiйного використання, який з'єднаний з катетером шляхом "часткового введення" в органiзм, не вважається активним iмплантованим медичним виробом.
Однiєю з важливих характеристик iмплантованого виробу є його вiдносно довготривале використання. Необхiдно вказати вiдмiннiсть в передбаченому використаннi виробу, який може в довготривалому порядку використовуватись протягом декiлькох мiсяцiв, у порiвняннi з тимчасовим користуванням протягом зазначеного медичного втручання. Зовнiшнiй електрокардiостимулятор, в тому числi його електрод, використовується тимчасово, отже, не вважається виробом, що "залишається в органiзмi людини пiсля завершення процедури". Те ж саме вiдноситься до використання внутрiшньоаортального балонного насоса. Згiдно з метою ТР щодо АМВI, термiн "процедура" повинен iнтерпретуватись як процес дiагностики, монiторингу та лiкування, який може тривати протягом декiлькох днiв, як правило, в лiкарнi, i не обов'язково стосуватись виключно хiрургiчної операцiї, в ходi якої вирiб був розмiщений всерединi органiзму.
2. Допомiжний засiб до активного медичного виробу, який iмплантують
1) "Допомiжний засiб" до активного медичного виробу, який iмплантують за визначенням є "активним медичним виробом, який iмплантують" та, на пiдставi цього, на них поширюється дiя ТР щодо АМВI. Вказане не передбачає, що властивостi "активний" та "вирiб, який iмплантують" обов'язково повиннi вiдповiдати вимогам до визначення виробу, як "допомiжнi засоби". Достатньою умовою є те, що продукт за його передбаченим використанням є допомiжним для цiлей застосування активного медичного виробу, який iмплантують таким чином, що це дозволяє використовувати медичний вирiб у вiдповiдностi з його передбаченим використанням, або для посилення цiлей застосування виробу, визначених його виробником. Згiдно з цим пристрiй програмування або зовнiшнiй передавач, призначений для активацiї або контролювання частини виробу, яка iмплантована, пiдпадає пiд дiю визначення "активний iмплантований медичний вирiб".
2) Репрезентативний перелiк активних медичних виробiв, якi iмплантують:
- електрокардiостимулятори, якi iмплантують;
- дефiбрилятори, якi iмплантують;
- проводи, електроди, адаптери для виробiв;
- нейростимулятори, якi iмплантують;
- стимулятори сечового мiхура;
- стимулятори сфiнктера;
- стимулятори дiафрагми;
- кохлеарнi iмплантати;
- активний вирiб для введення лiкарського засобу, який iмплантують;
- катетери, датчики для виробiв;
- активнi вироби монiторингу, якi iмплантують;
- вироби програмування, програмне забезпечення, передавачi.
| Генеральний директор Фармацевтичного директорату | Олександр КОМАРIДА |
| ЗАТВЕРДЖЕНО Наказ Мiнiстерства охорони здоров'я України 22 сiчня 2020 року N 142 |
МЕТОДИЧНI РЕКОМЕНДАЦIЇ
"Уповноважений представник"
ВСТУП
Методичнi рекомендацiї розроблено на основi Керiвного документа Європейської Комiсiї MEDDEV 2.5/10, сiчень 2012 року та не є юридично обов'язковими. Методичнi рекомендацiї розроблено задля однозначного тлумачення норм Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753, Технiчного регламенту щодо медичних виробiв для дiагностики in vitro, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 754, та Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755.
Обов'язковими є лише тексти технiчних регламентiв:
- Технiчного регламенту щодо медичних виробiв, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 753 (далi - ТР щодо МВ);
- Технiчного регламенту щодо медичних виробiв для дiагностики in vitro, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 754 (далi - ТР щодо МВ in vitro);
- Технiчного регламенту щодо активних медичних виробiв, якi iмплантують, затвердженого постановою Кабiнету Мiнiстрiв України вiд 02.10.2013 N 755 (далi - ТР щодо АМВI).
Текст технiчних регламентiв застосовується там, де iснують розбiжностi мiж положеннями технiчних регламентiв та змiстом даних рекомендацiй.
Протягом кiлькох рокiв висловлювались занепокоєння щодо вiдсутностi чiткого роз'яснення ролi уповноваженого представника. Особлива плутанина була викликана тим, що деякi виробники передавали певнi повноваження своїм уповноваженим представникам. Також плутанину викликала вiдсутнiсть чiткого перелiку даних, якi повиннi / можуть надавати уповноваженi представники.
1. Пiдсумки поточних положень технiчних регламентiв про медичнi вироби
Виробник, а не уповноважений представник, несе вiдповiдальнiсть за зобов'язання вiдповiдно до технiчних регламентiв.
Якщо виробник, який вводить вироби в обiг пiд власною назвою, є нерезидентом України, вiн повинен призначити уповноваженого представника.
Виробник може мати бiльш нiж одного уповноваженого представника, за умови, що один вирiб (мається на увазi один тип/модель виробу) пов'язаний тiльки з одним уповноваженим представником. Намiр такого положення - вiдсутнiсть обмеження одним представником для всього спектру продукцiї.
В iнформацiї на зовнiшнiй упаковцi або iнструкцiї iз застосування має мiститися адреса уповноваженого представника, якщо виробник є нерезидентом.
Мета цього примусового призначення - надання органам влади можливостi контакту з особою, яка несе вiдповiдальнiсть за розмiщення виробу на ринку України, особливо в надзвичайних випадках.
Уповноважений представник має певнi обов'язки, визначенi вiдповiдними технiчними регламентами, такi як:
- iнформування компетентних органiв влади про зареєстроване мiсцезнаходження (ТР щодо МВ: клас I, системи медичних виробiв та процедурнi набори, медичнi вироби, виготовленi на замовлення; ТР щодо АМВI: медичнi вироби виготовленi на замовлення; ТР щодо МВ in vitro: про вироби та сертифiкати;
- зберiгання певної iнформацiї для подальшого використання компетентними органами, такої як декларацiї про вiдповiднiсть та технiчної документацiї.
Виробник може доручити своєму уповноваженому представниковi iнiцiювати проведення процедур, передбачених у додатках 4, 5, 8 i 9 ТР щодо МВ.
Виробник може уповноважувати свого представника розпочати процедури оцiнки вiдповiдностi, наведенi в додатках 3, 5, 6 i 8 ТР щодо МВ in vitro.
Виробник може уповноважити свого представника iнiцiювати процедури, наведенi у додатках 3, 4, i 6 ТР щодо АМВI.
1) Роль уповноваженого представника
Загальнi данi
Так як технiчнi регламенти не включають детального опису ролi та зобов'язань уповноваженого представника, важливим для виробника та уповноваженого представника є укладення контракту iз зазначенням обов'язкiв та повноважень, якi виробник делегуватиме уповноваженому представниковi, також i у випадках, коли уповноважений представник є дочiрньою компанiєю / представництвом виробника.
Призначення уповноваженого представника не змiнює вiдповiдальностi виробника. Уповноважений представник повинен бути призначеним та знаходитися пiд наглядом виробника.
Уповноважений представник є представником виробника i буде безпосередньо нести вiдповiдальнiсть. Наприклад, його вiдповiдальнiстю може бути забезпечення проведення вiдповiдної процедури оцiнки вiдповiдностi та пiдтвердження того, що вирiб пройшов оцiнку вiдповiдностi. Ще один приклад - встановлення системи пост-маркетингового нагляду, сумiсною з такою ж системою виробника. Уповноважений представник таким чином буде повнiстю поiнформованим про свої зобов'язання. Такi зобов'язання повиннi бути вiдображенi у зазначеному вище договорi з виробником.
Призначення уповноваженого представника
Якщо виробник, який пiд власним iменем вводить в обiг медичнi вироби, зазначенi в абзацi першому цього пункту, не є резидентом України, вiн зобов'язаний призначити одного уповноваженого представника, вiдповiдального за введення в обiг цих виробiв на ринку України. Те саме стосується ТР щодо МВ in vitro без зазначення "один".
Уповноважений представник повинен бути єдиним уповноваженим представником у межах України для мiнiмум всiх виробiв того ж самого типу.
Виробник може мати рiзних уповноважених представникiв для рiзних виробiв (типiв).
Вимога мати уповноваженого представника застосовується для всiх медичних виробiв, розмiщених на ринку України, виробник яких знаходиться поза межами України.
Вимога мати уповноваженого представника також застосовується до виробiв, призначених для клiнiчних дослiджень (ТР щодо МВ, ТР щодо АМВI), або оцiнки характеристик (ТР щодо МВ in vitro), де виробник-нерезидент України.
Реєстрацiя
ТР щодо МВ та ТР щодо АМВI
Реєстрацiя уповноважених представникiв, виробникiв та виробiв
Уповноваженi представники призначенi для виробу, щодо якого iснує зобов'язання повiдомити Державну службу України з лiкарських засобiв та контролю за наркотиками (далi - Держлiкслужба) (ТР щодо МВ: клас I, системи медичних виробiв та процедурнi набори, медичнi вироби, виготовленi на замовлення; ТР щодо АМВI: медичнi вироби, виготовленi на замовлення), зобов'язанi зареєструвати у Держлiкслужбi своє мiсцезнаходження та виробника, а також надати перелiк i опис вiдповiдних виробiв.
Реєстрацiя Клiнiчних Дослiджень
Виробник або уповноважений представник повиннi проiнформувати Держлiкслужбу про намiри провести клiнiчнi дослiдження. Вони також iнформують про закiнчення таких дослiджень та надають письмовий звiт про клiнiчнi дослiдження. Виробник може передоручити такi завдання повнiстю або частково уповноваженим представникам.
ТР щодо МВ in vitro
Реєстрацiя уповноважених представникiв, виробникiв, виробiв та сертифiкатiв
Уповноважений представник, призначений для виробiв, якi пiдпадають пiд ТР щодо МВ in vitro, зобов'язаний зареєструвати у Держлiкслужбi своє мiсцезнаходження та виробника, iнформацiю щодо виробiв та сертифiкатiв.
Реєстрацiя оцiнки характеристик
Виробник-нерезидент України, який бажає здiйснити оцiнювання характеристику дiагностичного виробу, повинен призначити уповноваженого представника. Уповноважений представник передає iнформацiю про виробника та такий вирiб до Держлiкслужби. Заявка, необхiдна для оцiнювання характеристик виробу, видається виробником уповноваженому представниковi.
Оцiнювання вiдповiдностi
Технiчний регламент дозволяє виробниковi передати виконання деяких вимог Технiчних регламентiв призначеному уповноваженому представниковi. Це повинно бути окремо вказано у договорi мiж виробником та уповноваженим представником.
ТР щодо МВ
Виробник може доручити своєму уповноваженому представниковi iнiцiювати проведення процедур, передбачених у додатках 4, 5, 8 i 9.
- Подати заявку для оцiнки вiдповiдностi для перевiрки типу (додаток 4),
- Скласти декларацiю вiдповiдностi, включаючи додаток 8, пункт 5 у випадку з виробами, розмiщеними на ринку в стерильних умовах та виробiв класу I з функцiєю вимiрювання,
- Скласти заяву для виготовлених на замовлення виробiв (додаток 9, пункт 2.1).
ТР щодо АМВI
Виробник може уповноважити свого представника iнiцiювати процедури, наведенi у додатках 3, 4, i 6.
- Подати заявку для оцiнки вiдповiдностi для перевiрки типу (додаток 3),
- Скласти декларацiю вiдповiдностi типу, вказаному у сертифiкатi перевiрки типу (додаток 4),
- Скласти заяву для виготовлених на замовлення виробiв (додаток 6).
ТР щодо МВ in vitro
Виробник може уповноважувати свого представника розпочати процедури оцiнки вiдповiдностi, наведенi в додатках 3, 5, 6 i 8.
- Виконати вимоги додатка 3.
- Подати заявку для оцiнки вiдповiдностi для перевiрки типу (додаток 5).
- Скласти декларацiю вiдповiдностi типу, вказаному у сертифiкатi перевiрки типу (додаток 6).
Уповноважений представник буде контактною особою мiж органами влади та iншими органами, замiсть виробника, стосовно зобов'язань останнього згiдно технiчних регламентiв
Iнформацiя, яка вимагається вiд виробника
Уповноважений представник зобов'язується надавати певну iнформацiю до компетентних органiв, таку як декларацiї вiдповiдностi та технiчну документацiю.
Уповноважений представник повинен мати можливiсть надавати всю документацiю та iнформацiю, яку можуть запитувати компетентнi органи, з метою нагляду за ринком.
Iнформацiя може зберiгатися в уповноважених представникiв, якi мають повноваження передавати таку iнформацiю безпосередньо до компетентних органiв. У такому випадку, в договорi будуть зазначенi зобов'язання вiд виробника для постiйного оновлення iнформацiї.
Якщо виробник обирає не зберiгати iнформацiю в уповноважених представникiв, вiн надаватиме уповноваженим представникам всю документацiю та iнформацiю, якої можуть потребувати органи ринкового нагляду, з метою спостереження за ринком при отриманнi запиту, переданого уповноваженими представниками до виробника. Уповноваженi представники повиннi мати доступ до всiєї документацiї та iнформацiї.
У цьому випадку договiр повинен мiстити данi про те, що виробник надає iнформацiю, на яку здiйснено запит уповноваженим представникам завчасно, а також включати зобов'язання вiд виробника про своєчасне надання уповноваженим представникам iнформацiї про будь-якi змiни.
Уповноваженi представники повиннi розiрвати договiр з виробником, якщо вiн не забезпечує надання йому доступу до необхiдної iнформацiї.
Iнформацiя, на яку здiйснюється запит, може включати:
декларацiю вiдповiдностi;
копiї етикетки, упаковки та iнструкцiй iз застосування;
сертифiкати;
данi пост-маркетингового нагляду за ринком, звiти та скарги;
технiчну документацiю;
вiдповiднi клiнiчнi данi / повiдомлення;
деталi про дистриб'юторiв/постачальникiв, якi розмiщують вироби з маркуванням нацiональним знаком на ринку;
звiти про iнциденти та здiйсненi корегувальнi заходи.
Виробник повинен iнформувати своїх уповноважених представникiв щодо всiх питань, пов'язаних з виробами, розмiщеними на ринку України.
Iнформацiя, яку можна отримати вiд уповноважених представникiв
Уповноважений представник повинен iнформувати виробника щодо всiх питань, якi можуть бути пов'язанi з виробами, що розмiщуються на ринку України.
Значнi негативнi результати пiд час клiнiчних дослiджень, тобто перед введенням на ринок
Усi побiчнi ефекти повиннi бути повнiстю задокументованi i негайно доведенi до вiдома Держлiкслужби вiдповiдно до законодавства.
Забезпечення виконання обов'язкiв
У разi встановлення Держлiкслужбою або органами доходiв i зборiв факту нанесення маркування знаком вiдповiдностi технiчним регламентам з порушенням вимог законодавства або вiдсутностi такого маркування, уповноважений представник повинен привести медичнi вироби у вiдповiднiсть. Врегулювання потребують також випадки, коли маркування знаком вiдповiдностi технiчним регламентам було нанесене на вироби, на якi не поширюється їх дiя.
2. Договiр мiж виробником та уповноваженим представником
Виробники передоручатимуть свої права безпосередньо уповноваженим представникам i це бажано зазначати в письмовому договорi. Вони визначатимуть завдання уповноважених представникiв та межi їхнiх повноважень.
Для того, щоб переконатися, що ролi представника та виробника є чiткими, рекомендовано, щоб їх зобов'язання були викладенi в письмовiй формi у договорi мiж виробником та його уповноваженим представником.
Договiр мiж виробником та уповноваженим представником повинен зазначати, що уповноважений представник зобов'язується iнформувати виробника про рiшення компетентного органу вiдносно вiдмови або заборони допуску виробу на ринок або будь-якi дiї, пов'язанi з введенням в експлуатацiю виробу.
Договiр мiж виробником та уповноваженим представником зазначає те, що уповноважений представник зобов'язується iнформувати виробника про вiдомi йому несприятливi ситуацiї.
Договiр мiж виробником та уповноваженим представником зазначатиме, що виробник зобов'язується iнформувати уповноваженого представника з усiх питань, пов'язаних з виробами, якi були розмiщеними на ринку України.
Орган з оцiнки вiдповiдностi перевiряє, щоб виробник-нерезидент призначив уповноваженого представника та уклав договiр, в якому зазначив передоручення вiдповiдних обов'язкiв.
Нижче перелiченi очiкування компетентних органiв влади. Це, в iдеалi, повинно бути зазначено у договорi мiж виробником та уповноваженим представником.
- Уповноважений представник повинен вмiти оцiнити здатнiсть виробника виконувати свої регуляторнi зобов'язання. Для того, щоб виконувати оцiнювання, уповноважений представник повинен мати доступ до технiчної документацiї.
- Уповноваженi представники повиннi мати змогу перевiрити iснування необхiдної iнформацiї/документацiї у виробника та виконання ним вiдповiдних процесiв (наприклад, пост-ринковий нагляд).
- Уповноваженi представники повиннi мати вiдповiднi знання, навички та ресурси для оцiнювання та перевiрки зазначеного.
- Компетентнi органи повиннi мати змогу отримати на запит наступну iнформацiю вiд уповноваженого представника:
декларацiю вiдповiдностi;
копiю маркування, упаковки та iнструкцiю з користування;
сертифiкати органу з оцiнки вiдповiдностi (де необхiдно);
данi про процеси пост-ринкового нагляду, звiти та скарги, данi про iншi процеси;
технiчну документацiю, яка необхiдна пiд час нагляду за ринком;
вiдповiднi клiнiчнi данi / повiдомлення;
данi про дистриб'юторiв/постачальникiв, якi постачають вироби на ринок;
звiти про iнциденти та здiйсненi корегувальнi дiї.
У випадку виникнення суперечностей, де уповноваженi представники вважатимуть, що виробник не вiдповiдає вимогам технiчних регламентiв, його обов'язком є здiйснення переговорiв стосовно таких суперечностей з виробником. Якщо суперечнiсть триває, питання повинне бути передано до компетентних органiв для отримання рiшення. Уповноважений представник має право розiрвати договiр.
У випадку наявностi недотримання виробником умов, якi стосуються вiдповiдальностi уповноваженого представника та якi виробник вiдмовляється виправити, уповноважений представник має право розiрвати договiр з виробником. Уповноважений представник має право розiрвати договiр, якщо невиконання обов'язкiв виробника викликає порушення державного законодавства з боку уповноваженого представника. Уповноваженi представники повиннi проiнформувати про це компетентнi органи та орган з оцiнки вiдповiдностi виробника.
3. Нормативнi вимоги
В таблицi зазначено статтi та роздiли додаткiв до технiчних регламентiв в сферi медичних виробiв, якi мiстять вимоги стосовно уповноважених представникiв.
| ТР щодо МВ | ТР щодо МВ in vitro | ТР щодо АМВI |
| Призначення | ||
| Пункт 31 абзац 2. Якщо виробник, який пiд власним iменем вводить в обiг медичнi вироби, зазначенi в абзацi першому цього пункту, не є резидентом України, вiн зобов'язаний призначити одного уповноваженого представника, вiдповiдального за введення в обiг цих виробiв на ринку України. |
Пункт 16 абзац 5. У разi, коли виробник не є резидентом України, обов'язок щодо надання доступу до зазначеної документацiї для уповноважених органiв державної влади покладається на його уповноваженого представника. |
Пункт 34. Якщо виробники не є резидентами України, вони повиннi призначити уповноваженого представника в Українi. |
| Реєстрацiя | ||
| Пункт 31 абзац 2. Такий представник зобов'язаний повiдомити Держлiкслужбу щодо свого мiсцезнаходження i надати перелiк та опис вiдповiдних виробiв. Пункт 31 абзац 1. Будь-який виробник, який пiд власним iменем вводить медичнi вироби в обiг, згiдно з процедурами, зазначеними у пунктах 18 i 19 цього Технiчного регламенту, а також будь-яка iнша фiзична особа - пiдприємець або юридична особа, яка провадить дiяльнiсть, зазначену в пунктах 27 - 30 цього Технiчного регламенту, зобов'язана повiдомити Держлiкслужбi щодо свого мiсцезнаходження i надати перелiк та опис вiдповiдних виробiв. |
Пункт 23 абзац 10. У разi, коли виробник, який вводить в обiг вироби пiд своїм найменуванням, не є резидентом України, iнформацiя подається Держлiкслужбi уповноваженим представником, якого вiн призначає. Пункт 23. Виробник, який пiд своїм найменуванням вводить в обiг вироби, повiдомляє Держлiкслужбi: - своє мiсцезнаходження; - вiдомостi про реагенти, реагентнi продукти, калiбратори, контрольнi матерiали та про будь-якi iстотнi змiни, включаючи припинення введення в обiг; - щодо виробiв, зазначених у додатку 2, та виробiв для самоконтролю - данi, що необхiднi для iдентифiкацiї таких виробiв, аналiтичнi та в разi потреби дiагностичнi параметри вiдповiдно до пункту 3 додатка 1, результати оцiнки характеристик згiдно з додатком 8, iнформацiю про виданi сертифiкати та про будь-якi iстотнi змiни, включаючи припинення введення в обiг; - iнформацiю про вирiб, який є новим виробом, iз зазначенням iнформацiї про маркування виробу знаком вiдповiдностi технiчним регламентам. |
Пункт 33 абзац 1. Держлiкслужба може запитувати у виробникiв зазначених виробiв або їх уповноважених представникiв усi данi щодо iдентифiкацiї таких виробiв, зокрема за етикеткою, iнструкцiєю iз застосування тощо. Пункт 33 абзац 1. Виробник, що є резидентом України та пiд власним найменуванням вводить в обiг вироби, виготовленi на замовлення вiдповiдно до процедури, зазначеної в пунктi 20 цього Технiчного регламенту, повiдомляє Держлiкслужбi про своє мiсцезнаходження, а також надає перелiк i опис вiдповiдних виробiв. |
| Процедура оцiнювання вiдповiдностi | ||
| Пункт 21. Виробник може доручити своєму
уповноваженому представниковi iнiцiювати
проведення процедур, передбачених у додатках 4, 5,
8 i 9. Дивись також: Додаток 4 пункт 2 Додаток 5 пункт 1 Додаток 8 пункт 1 Додаток 9 пункт 1 |
Пункт 15. Виробник може уповноважувати свого
представника розпочати процедури оцiнки
вiдповiдностi, наведенi в додатках 3, 5, 6 i 8. Дивись також Додаток 3 пункт 1 Додаток 5 пункт 2 Додаток 6 пункт 1 Додаток 8 пункт 1 |
Пункт 21. Виробник може уповноважити свого
представника iнiцiювати процедури, наведенi у
додатках 3, 4, i 6. Дивись також Додаток 2 пункт 2 Додаток 3 пункт 2 Додаток 4 пункти 1 та 2 Додаток 5 пункт 2 Додаток 6 пункт 1 |
| Документацiя оцiнювання вiдповiдностi | ||
| Додаток 4 пункт 7. Iншi органи з оцiнки вiдповiдностi можуть отримати копiї сертифiкатiв перевiрки типу та/або додаткiв до них. Iншим органам з оцiнки вiдповiдностi надається доступ до додаткiв сертифiкатiв на їх обґрунтований запит пiсля iнформування виробника про такий запит. Додаток 5 пункт 11. Виробник або його уповноважений представник не менш як п'ять рокiв, а для медичних виробiв, якi iмплантують, - не менш як п'ятнадцять рокiв з моменту виготовлення останнього медичного виробу повинен зберiгати для надання на запит уповноважених органiв державної влади такi документи: - декларацiю про вiдповiднiсть; - документацiю, зазначену в пунктi 2 цього додатка; - сертифiкати, зазначенi в пунктах 6 i 10 цього додатка; - сертифiкат перевiрки типу, зазначений в додатку 4 до Технiчного регламенту щодо медичних виробiв. Додаток 6 пункт 12 Виробник або його уповноважений представник не менш як п'ять рокiв, а для медичних виробiв, якi iмплантують, - не менш як п'ятнадцять рокiв з моменту виготовлення останнього медичного виробу повинен зберiгати для надання на запит Держлiкслужби: - декларацiю про вiдповiднiсть; - документацiю щодо систем управлiння якiстю, зазначену в пунктi 3 цього додатка; - змiни, зазначенi в пунктi 7 цього додатка; - рiшення та звiти органу з оцiнки вiдповiдностi, про якi йдеться в пунктах 10 i 11 цього додатка; - технiчну документацiю на затвердженi типовi зразки та копiї сертифiкатiв перевiрки типу, зазначених в додатку 4 до Технiчного регламенту щодо медичних виробiв. Додаток 7 пункт 8 Виробник або його уповноважений представник не менш як п'ять рокiв, а для медичних виробiв, якi iмплантують, - не менш як п'ятнадцять рокiв з моменту виготовлення останнього медичного виробу повинен зберiгати для надання на запит Держлiкслужби такi документи: - декларацiю про вiдповiднiсть; - технiчну документацiю на затвердженi типовi зразки та копiї сертифiкатiв перевiрки типу; - змiни, зазначенi в пунктi 5 цього додатка; - рiшення та звiти органу з оцiнки вiдповiдностi, про якi йдеться в пунктах 5 i 7 цього додатка; - в разi потреби - сертифiкат перевiрки типу, зазначений у додатку 4 до Технiчного регламенту щодо медичних виробiв. Додаток 8 роздiл 2 Виробник повинен пiдготувати технiчну документацiю, зазначену в пунктi 3 цього додатка. Виробник або його уповноважений представник протягом п'яти рокiв з моменту виготовлення останнього медичного виробу повинен зберiгати для надання на запит Держлiкслужби технiчну документацiю, зокрема декларацiю про вiдповiднiсть, з метою її перевiрки. У випадку з iмплантованими виробами такий термiн складатиме 15 рокiв. Додаток 9 пункт 4 Iнформацiя, що мiститься в заявах, передбачених цим додатком, зберiгається не менш нiж п'ять рокiв. Строк зберiгання iнформацiї про медичнi вироби, якi iмплантують, становить не менш нiж п'ятнадцять рокiв. |
Пункт 16. Виробник протягом п'яти рокiв пiсля виготовлення останнього виробу зберiгає: - декларацiю про вiдповiднiсть; - технiчну документацiю, зазначену в додатках 3 - 8; - рiшення та сертифiкати органiв з оцiнки вiдповiдностi. У разi, коли виробник не є резидентом України, обов'язок щодо надання доступу до зазначеної документацiї для уповноважених органiв державної влади покладається на його уповноваженого представника. |
Додаток 2 пункт 16. Виробник або його уповноважений представник протягом не менш як 15 рокiв з моменту виготовлення останнього виробу повинен зберiгати для надання в разi потреби Держлiкслужбi: - декларацiю про вiдповiднiсть; - документацiю, зазначену пунктi 3 цього додатка, а також документацiю, данi i записи, зазначенi в пунктi 4 цього додатка; - змiни, зазначенi в пунктах 7 i 9 цього додатка; - рiшення та звiти органiв з оцiнки вiдповiдностi, зазначенi в пунктах 7, 10, 14 i 15 цього додатка. Додаток 3 пункт 9. Виробник або його уповноважений представник протягом не менш як 15 рокiв з моменту виготовлення останнього виробу повинен зберiгати разом з технiчною документацiєю копiю сертифiката перевiрки типу та додатки до нього для надання на запит Держлiкслужби. Додаток 4 пункт 10 Виробник або його уповноважений представник забезпечують можливiсть надання сертифiкатiв вiдповiдностi, виданих органом з оцiнки вiдповiдностi, на вимогу iнших органiв з оцiнки вiдповiдностi та уповноважених органiв державної влади. Додаток 6 роздiл 3 Виробник зобов'язаний зберiгати для Держлiкслужби такi документи: 1) для виробiв, виготовлених на замовлення, - документацiю, в якiй наводиться опис виробничих дiлянок, а також iнформацiю про розроблення, виробництво та експлуатацiйнi характеристики виробiв, зокрема очiкуванi експлуатацiйнi показники, для забезпечення можливостi оцiнки виконання вимог Технiчного регламенту. Виробник зобов'язаний вжити всiх необхiдних заходiв для забезпечення виготовлення виробiв вiдповiдно до зазначеної документацiї; 2) для виробiв, призначених для клiнiчних дослiджень, - документацiю, в якiй наводиться: - загальний опис виробу та його призначення; - проектнi креслення, iнформацiю про методи виробництва, зокрема методи стерилiзацiї, а також схеми компонентiв, вузлiв, ланцюгiв тощо; - описи та пояснення, необхiднi для розумiння зазначених креслень, схем, а також принципiв роботи виробу; - результати аналiзу ризикiв, iнформацiя про стандарти, що застосовуються повнiстю або частково, з числа тих, що включенi до перелiку нацiональних стандартiв, якi вiдповiдають європейським гармонiзованим стандартам та добровiльне застосування яких може сприйматися як доказ вiдповiдностi виробiв вимогам Технiчного регламенту, а також опис рiшень, прийнятих з метою виконання встановлених вимог Технiчного регламенту у разi часткового застосування зазначених стандартiв; - якщо вирiб мiстить як невiд'ємну частину речовину або похiднi кровi людини, зазначенi в пунктi 11 додатка 1 до Технiчного регламенту, - данi про випробування, проведенi у зв'язку з цим, необхiднi для оцiнювання безпеки, якостi та ефективностi даної речовини або похiдних кровi людини з урахуванням цiльового призначення цього виробу; - результати проектних розрахункiв та проведених перевiрок i технiчних випробувань тощо. Виробник зобов'язаний вжити всiх необхiдних заходiв для забезпечення виготовлення виробiв вiдповiдно до документацiї, зазначеної у пiдпунктi 1 пункту 3 цього додатка та абзацi першому цього пiдпункту. Виробник повинен забезпечити проведення оцiнки за необхiдностi шляхом проведення перевiрки ефективностi зазначених заходiв. |
| Маркування | ||
| Додаток 1 пункт 44 Етикетка медичного виробу повинна мiстити такi елементи: 1) найменування або торгову марку i мiсцезнаходження виробника. Для медичних виробiв, що iмпортуються з метою введення в обiг, на етикетцi або зовнiшньому пакуваннi, або в iнструкцiї iз застосування додатково зазначається найменування та мiсцезнаходження уповноваженого представника, якщо виробник не є резидентом України. |
Додаток 1 пункт 40 Етикетка виробу повинна мiстити таку iнформацiю, що може наводитися у формi символiв: найменування або торгову марку та мiсцезнаходження виробника. Для виробiв, що iмпортуються з метою введення в обiг, на етикетцi або зовнiшньому пакуваннi, або в iнструкцiї iз застосування додатково зазначається найменування та мiсцезнаходження уповноваженого представника, якщо виробник не є резидентом України. |
Додаток 1 пункт 15. Кожен вирiб повинен мiстити такi вiдомостi (в разi можливостi - у виглядi символiв), нанесенi чiтко i розбiрливо: 1) на стерильнiй упаковцi: метод стерилiзацiї; позначення, що дозволяє розпiзнати упаковку; найменування та мiсцезнаходження виробника; опис виробу; напис: "виключно для клiнiчних дослiджень", якщо вирiб призначений для клiнiчних дослiджень; напис: "вирiб, виготовлений на замовлення", якщо вирiб виготовлений на замовлення; повiдомлення, що вирiб є стерильним; мiсяць i рiк виробництва; зазначення строку придатностi для безпечної iмплантацiї виробу; 2) на зовнiшнiй упаковцi: найменування та мiсцезнаходження виробника i найменування та мiсцезнаходження уповноваженого представника, якщо виробник не є резидентом України; опис виробу; призначення виробу; характеристики для використання; напис: "виключно для клiнiчних дослiджень", якщо вирiб призначений для клiнiчних дослiджень; напис: "вирiб, виготовлений на замовлення", якщо вирiб був виготовлений на замовлення; повiдомлення, що вирiб є стерильним; мiсяць i рiк виробництва; зазначення строку придатностi для безпечної iмплантацiї виробу; умови транспортування i зберiгання виробу; для виробу, зазначеного у пунктi 5 Технiчного регламенту, зазначається, що вирiб мiстить речовину, отриману з кровi або плазми кровi людини. |
| Клiнiчнi дослiдження / оцiнка характеристик | ||
| Пункт 32 абзац 1 У разi виготовлення медичних виробiв, призначених для клiнiчних дослiджень, виробник або його уповноважений представник, зареєстрований в Українi, повиннi дотримуватися процедури, зазначеної в додатку 10, i повiдомити про це Держлiкслужбi шляхом подання заяви, вимоги щодо заповнення якої зазначенi в пунктi 2 додатка 10. |
Додаток 8 пункт 1 Для введення в обiг виробiв, призначених для оцiнки характеристик, виробник або його уповноважений представник повинен скласти заявку, що мiстить iнформацiю, зазначену в пунктi 2 цих Процедур, i забезпечити виконання вiдповiдних положень Технiчного регламенту щодо медичних виробiв для дiагностики in vitro. |
Пункт 28 У разi виготовлення виробiв, призначених для клiнiчних дослiджень, виробник або його уповноважений представник за 60 календарних днiв до початку дослiджень повинен подати Держлiкслужбi заяву щодо виробiв особливого призначення, вимоги до якої наведенi у додатку 6. |
| Застосування прав | ||
| Пункт 46 У разi встановлення Держлiкслужбою або органами доходiв i зборiв факту нанесення маркування знаком вiдповiдностi технiчним регламентам з порушенням вимог законодавства або вiдсутностi такого маркування, що є порушенням цього Технiчного регламенту, виробник або його уповноважений представник повиннi привести медичнi вироби у вiдповiднiсть з вимогами цього Технiчного регламенту. |
Пункт 32 У разi встановлення Держлiкслужбою або органами доходiв i зборiв факту нанесення маркування знаком вiдповiдностi технiчним регламентам з порушенням вимог законодавства або вiдсутностi такого маркування, що є порушенням вимог цього Технiчного регламенту, виробник або його уповноважений представник повиннi привести вироби у вiдповiднiсть з вимогами цього Технiчного регламенту. |
Пункт 44 У разi встановлення Держлiкслужбою або органами доходiв i зборiв факту нанесення маркування знаком вiдповiдностi технiчним регламентам з порушенням вимог законодавства або вiдсутностi такого маркування, що є порушенням вимог цього Технiчного регламенту, виробник або його уповноважений представник повинен привести вироби у вiдповiднiсть з вимогами цього Технiчного регламенту. |
| Рiшення вiдносно заборони або вiдмови | ||
| Пункт 47 Якщо порушення не усунуто, Держлiкслужба або органи доходiв i зборiв вживають заходiв щодо обмеження або заборони введення в обiг медичного виробу або мають переконатися, що вiн виведений з обiгу, в установленому законодавством порядку. |
Пункт 33 Якщо порушення залишається, Держлiкслужба або органи доходiв i зборiв вживають заходiв до обмеження чи заборони введення в обiг виробу або повиннi переконатися, що вiн виведений з обiгу в установленому законодавством порядку. |
Пункт 45 Якщо порушення залишається, Держлiкслужба або органи доходiв i зборiв вживають заходiв обмеження або заборони введення в обiг виробу або повиннi переконатися, що вiн виведений з обiгу в установленому законодавством порядку. |
| Генеральний директор Фармацевтичного директорату |
Олександр КОМАРIДА |
 | Copyright © 2025 НТФ «Интес» Все права сохранены. |